电解质溶液提高练习一
(满分:150 时间:120分钟)
一、选择题(本题包括20小题,每小题3分,共60分,每小题有一个或两个正确答案)
1、将pH=5的H2SO4溶液稀释500倍,稀释溶液后的,C(H+)与C(SO42-)的比值近似为
A.1:1 B.1:2 C.10:1 D.2:1
2、向0.05mol/L的氢硫酸中通入Cl2至H2S刚好被完全氧化,若不考虑溶液体积变化,反应后溶液的pH为
A.2 + lg5 B.2 - lg5 C.1 D.2
3、酸雨是因为过度燃烧煤和石油制品时,生成硫的氮的氧化物溶于雨水生成硫硫酸和硝酸的缘故。某次酸雨分析数据如下:C(NH4+)=2×10-5mol/L, C(Cl-)=7×10-5mol/L, C(SO42-)=2.8×10-5mol/L C(NO3-)=2.4×10-5mol/L C(Na+)=3×10-5mol/L,据此计算此次酸雨的pH大约为
 A.6
B.5
C.4
D.3
A.6
B.5
C.4
D.3
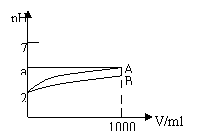
4、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图,下列说法正确的是
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都有是弱酸,则5>a>2
5、已知NaHCO3水溶液呈弱碱性。下列关于0.1mol/LNaHCO3溶液中有关微粒浓度的大小关系正确的是
A、[Na+]+ [H+]=[HCO3-]+2[CO32-]+[OH-] B、[Na+]+ [H+]=[HCO3-]+ [CO32-]+[OH-]
C、[Na+]=[HCO3-]+ [CO32-]+[H2CO3] D、[Na+]>[HCO3-]>[CO32-]>[H2CO3]
6、草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol•L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4—)+c(OH—)+c(C2O42-) B.c(HC2O4-)+c(C2O42-)=0.1 mol•L-1
C.c(C2O42—)>c(H2C2O4) D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—)
7、下列叙述中正确的是
A.强电解质溶液的导电能力一定比弱电解质的溶液导电能力强
B.因为醋酸是弱电解质,盐酸是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗NaOH比中和盐酸消耗NaOH少
C.强电解质一定是离子化合物,弱电解质一定是共价化合物
D.强电解质是易溶化合物,弱电解质是难溶化合物
E.SO3溶于水后导电性很强,所以SO3是强电解质
F.溶液中电离出的离子与未电离的分子共同存在的物质是弱电解质
8、H+浓度相同的等体积的两份溶液A(盐酸)和B(醋酸),分别和等量的Zn反应。
(1)若反应后有一份溶液中有锌剩余,则正确的判断是
(2)若反应后A、B放出的H2一样多,则正确的判断是
①反应所需时间B>A ②开始时反应速率A>B ③参加反应的锌的质量A=B
④整个反应阶段平均速率B>A ⑤盐酸里锌有剩余 ⑥醋酸里锌有剩余
(1)A.④⑤ B.①③⑥ C.③⑥ D.②③④⑥
(2)A.③④ B.①④⑤ C.②⑥ D.②③④
9、某一元弱酸溶液中,未电离的弱酸分子和电离出的阴阳离子之和的物质的量之比为9:2,则已电离的此酸分子占原来总分子数的百分数为
A.10% B.11% C.18% D.22%
10、用标准溶液滴定氢氧化钠时,由于待测液中含有少量碳酸钠,这样使求得的氢氧化钠的物质的量浓度
A.偏低 B.偏高 C.不能确定 D.不受影响
11、在一溶液中含有的溶质是NaOH,NaHCO3,Na2CO3中的一种或两种。现取等体积的两份上述溶液分别以酚酞和甲基橙作指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1 mL和V2 mL,如果V1<V2<2V1,则上述溶液中的溶质是
A. NaHCO3 B. Na2CO3 C. NaHCO3和Na2CO3 D. NaOH和Na2CO3
12、常温下,已知某强酸溶液的pH=a,某强碱溶液的pH=b,将强酸和强碱按Va:Vb的体积比混合后,溶液的pH=7。则混合前强酸,强碱溶液的pH值之间的关系为
A.a + b = 14 + lg(Va/Vb) B.a+b=14
C. a + b = 14 + lg(Vb / Va) D.aVa = bVb
13、为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3 ②KCl ③Ca(H2PO4)2④(NH4)2SO4⑤氨水,最适合的组合是
A.①③④ B.②③④ C.①③⑤ D.②③⑤
14、已知0.1mol/L NaHCO3溶液的pH为8.4, 0.1mol/L Na2CO3溶液的pH为11.4,则NaHCO3 水解产生的C(OH)是Na2CO3水解产生的C(OH)的
A.5倍 B.1/3倍 C.103倍 D.10-3倍
15、pH值相同的盐酸溶液和醋酸溶液分别与锌反应,若最后锌都全部溶解,且放出的气体一样多,则下列判断中正确的是
A.整个反应阶段的平均反应速率:醋酸>盐酸 B.反应所需的时间:盐酸<醋酸
C.开始时的反应速率:盐酸>醋酸 D.参加反应的锌的质量:盐酸=醋酸
16、已知c(NH4Cl)≤ 0.1 mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10 mL 0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为
A. 10 mL B. 5 mL C. 大于5 mL D. 小于5 mL
17、NH4Cl溶于重水(D2O)产物的化学式是
A. NH3 ·D2O和HD2O+ B. NH3·HDO和D3O+ C. NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
18、已知K2HPO4溶液中,HPO42―的水解程度大于电离程度,对于平衡:HPO42― + H2O H3O+ + PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-) 三种离子溶度均减小,可采用的方法是
A. 加水 B. 加热 C. 加消石灰 D. 加硝酸银
19、把0.05 mol NaOH (s) 分别加入100mL下列溶液中,溶液的导电能力变化最小的是
A.自来水 B. 0.5mol/L的盐酸
C.0.5mol/L的醋酸 D. 0.5mol/L的KCl溶液
20、化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02mol·L-1的下列各溶液(1)盐酸(2)石灰水(3)NaCl溶液(4)NaHSO4溶液(5)NaHCO3溶液(6)氨水,其中能使指示剂显红色的是
A.(1)(4)(5) B.(2)(5)(6) C.(1)(4) D.(2)(3)(6)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
二、填空题(本题共4小题,共42分)
21、(21分)含有NaOH,Na2CO3,NaHCO3中的一种或两种物质组成的混合溶液,为确定其成分,用标准盐酸滴定。用酚酞作指示剂时,耗用标准盐酸的体积为V1L,酚酞的变色范围8~10,当酚酞由红经粉红恰好变为无色时,加入甲基橙指示剂,用标准盐酸继续滴定,当甲基橙由黄变橙时,又耗用V2L盐酸,甲基橙变色范围是3.1~4.4(NaHCO3不能使酚酞试液显红色)
当V1,V2的关系如下时,盐酸的物质的量浓度为Mmol/L时,填写溶液的成分和它们的物质的量。
(1)V1≠0,V2=0:成分: ,物质的量
(2) V1=0,V2≠0成分: ,物质的量
(3) V1= V2≠0成分: ,物质的量
(4) V1> V2>0成分: ,物质的量
(5) V2> V1>0成分: ,物质的量
22、(6分)已知25℃时,0.1mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了OH-浓度,因而溶液的pH增大;
乙同学认为醋酸钠溶于水可电离出大量的CH3COO-离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大。
对上述两位同学的解释你认为哪种是正确的?为了验证上述哪种解释正确,你怎样利用下列所给的哪种物质进行怎样的实验?
A.CH3COOK固体 B. CH3COONH4固体 C. 氨气 D. NaHCO3固体
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________
23、(6分)限用下列试剂:酚酞、石蕊、稀硝酸、CH3COONa晶体、浓盐酸、Ca(OH)2粉末、CH3COONH4 晶体和蒸镏水。根据:①弱酸在水中存在电离平衡;②弱酸根阴离子会破坏水的电离平衡。这两个平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两个实验方案证明CH3COOH是弱酸,请简述实验方法及现象。
(1)应用根据①的实验方法及现象 。
(2)应用根据②的实验方法及现象 。
24、(10分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①![]() ②
②![]()
③![]()
回答下列问题:
1)相同条件下,HA、![]() 、
、![]() 三种酸中酸性最强的是_______________________.
三种酸中酸性最强的是_______________________.
2)![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、HC2- 6种离子中,最易结合质子的是________,
、HC2- 6种离子中,最易结合质子的是________,
最难结合质子的是________.
3)判断下列反应的离子方程式中正确的是(填写标号)__________________________.
A.![]() B.
B.![]() C.
C.![]()
4)完成下列反应的离子方程式.
A.![]() (过量)__________________________;
(过量)__________________________;
B.HA(过量)![]() __________________________.
__________________________.
三、计算题(本题共3小题,共48分)
25、(17分)实验室为测定某工业废水中含酚(以苯酚计)量,进行如下操作:
(1)分别称取![]() 和
和![]() ,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
(2)称取_____________![]() ,用同样方法准确配制
,用同样方法准确配制![]() 的标准溶液。
的标准溶液。
(3)准确量取100mL含酚(以苯酚计)水样,准确滴加![]() 混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成
混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成![]() ,立即跟苯酚反应生成沉淀。
,立即跟苯酚反应生成沉淀。
(4)上述反应完成后,再加入约1 g KI,放置5 min,然后用_____________作指示剂,再用![]() 标准溶液滴定至蓝色恰好消失为止(反应为:
标准溶液滴定至蓝色恰好消失为止(反应为:![]() ),用去
),用去![]() 溶液。
溶液。
(5)求水中酚的含量(![]() )是否符合国家有关废水允许排放的标准?(国家标准为酸的含量≤
)是否符合国家有关废水允许排放的标准?(国家标准为酸的含量≤![]() )
)
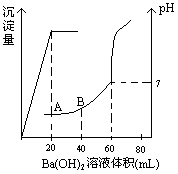
26、(15分)有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25![]() 氢氧化钡溶液时,生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时,生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
|
|
(2) A点、B表示的溶液,pH各是多少?
27、(16分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
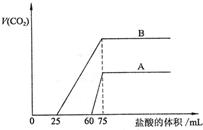
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。(3)通过计算求出原NaOH溶液的物质的量浓度。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| C | C | C | CD | AC | CD | F | A | A | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | |
| D | A | B | D | AD | C | B | C | B | C | |
21、(21分)每格1.5分
(1)V1≠0,V2=0:成分: NaOH ,物质的量 MV1
(2) V1=0,V2≠0成分: NaHCO3 ,物质的量 MV2
(3) V1= V2≠0成分: Na2CO3 ,物质的量 MV1
(4) V1> V2>0成分: NaOH Na2CO3 ,物质的量 M(V1-V2) MV2
(5) V2> V1>0成分: Na2CO3 NaHCO3 ,物质的量 MV1 M(V2-V1)
22、(6分)乙同学的解释是正确的。可利用CH3COONH4进行实验证明。(2分)
由已知电离度知,CH3COONH4溶于水后,CH3COO-与NH4+水解程度相同,CH3COONH4溶于水本身不会改变pH大小。但在CH3COOH溶液中加入CH3COONH4后,其电离出的CH3COO-对CH3COOH的电离过程的抑制作用与CH3COONa电离出的CH3COO-作用相同,即可以使CH3COOH的电离平衡向左移动,[H+]减小,pH增大。(4分)
23、(6分)取少量CH3COOH溶液,滴加石蕊试液,溶液呈红色,然后向其中加入CH3COONH4晶体、振荡,可看到红色变浅,说明CH3COOH中存在电离平衡,既CH3COOH为弱酸。(3分)(2)取少量CH3COONa 晶体溶于水,滴加酚酞试液,溶液呈红色,即CH3COO― 水解,破坏了水的电离平衡,说明CH3COOH是弱酸。(3分)
24、(2+2+2+4分)(1)![]() (2)
(2) ![]() ,
,![]() (3)BC
(3)BC
(4)![]()
![]()
25、(17分)
(1)玻璃棒;容量瓶;胶头滴管(2)24.8 (4)淀粉(3+2+2分)
(5)设![]() 混合液遇酸反应后生成
混合液遇酸反应后生成![]() 的物质的量为
的物质的量为![]()
![]() (1分)
(1分)
1 3
![]() x
x ![]() (2分)
(2分)
设过量的![]() 的物质的量为
的物质的量为![]() ,由
,由![]()
知:![]() (2分)
(2分)
则与苯酚反应的溴的物质的量![]() (1分)
(1分)
设100mL废水中苯酚的物质的量为zmol
由 (1分)
(1分)
知:![]() (1分)
(1分)
废水中苯酚的含量为![]()
可知,超过国家标准,不能排放。(2分)
26、(15分)
(1)从图中可知,60mL Ba(OH)2溶液恰好中和10mL混酸。(1分)则:
[H+]×10 = (0.025×2)×60,解得:[H+]
= 0.3![]() (2分)
(2分)
设[H2SO4]为C1,[HCl]为C2,从图中可知,20mL Ba(OH)2恰好跟H2SO4完全反应,则:0.025×20 = C1×10,解得C1 = 0.05![]() ,C2 = 0.3-0.05×2 = 0.2
,C2 = 0.3-0.05×2 = 0.2![]() 。(4分)
。(4分)
(2)A点:因为20mL Ba(OH)2正好将混酸中H2SO4中和完全,所以混酸中只有HCl。(1分)则[H+] = ![]()
![]() (2分),pH = -lg6.7
(2分),pH = -lg6.7![]() 10-2 = 1.17。(1分)B点:混酸中的HCl被加入的(40-20)mL Ba(OH)2溶液中和了一部分,(1分)
10-2 = 1.17。(1分)B点:混酸中的HCl被加入的(40-20)mL Ba(OH)2溶液中和了一部分,(1分)
则[H+]
= ![]()
![]() (2分), pH = -lg2
(2分), pH = -lg2![]() 10-2 = 1.7。(1分)
10-2 = 1.7。(1分)
27、(16分)(1) NaOH、Na2CO3 3∶1 33.6 (5分) (2)Na2CO3、NaHCO3 (2分) 1∶1 (2分) 112(1分)
(3)
解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积为75mL。(2分)
所以原NaOH溶液的物质的量浓度为:
![]() (4分)
(4分)