南京师范大学附属扬子中学高三年级
专题训练(离子方程式)
班级________姓名________得分_________
[1].经实验测得某一溶液由Mg2+、Al3+、NO3-、SO![]() 四种离子组成,其中Mg2+、Al3+、SO
四种离子组成,其中Mg2+、Al3+、SO![]() 离子的个数比可能为
离子的个数比可能为
A.3︰1︰10 B.3︰5︰1 C.3︰10︰1 D.3︰1︰5
[2].某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2- B.S2-和NO3- C.SiO32-和NO3- D.四种离子都减少
[3].下列反应完成后没有沉淀的是
A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH
B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4
C.AgNO3溶液与Na2CO3溶液加足量稀HCl
D.Ca(OH)2溶液与FeCl3溶液加足量稀HNO3
[4].下列各级物质的稀溶液相互反应,无论是前者滴入后者还是后者滴入前者,反应现象都相同的是:①NaHSO4和Ba(OH)2 ②AlCl3和NaOH ③Na2O2和H2SO4
④Ba(HCO3)2和Ba(OH)2 ⑤AgNO3和NH3·H2O
A.①②④⑤ B.①④⑤ C.①③⑤ D.其他组合
[5].下列离子方程式中,正确的是
A.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O
B.硫酸铜溶液中通入硫化氢:Cu2++H2S→CuS↓+2H+
C.碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
D.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O
[6].下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.钠与水的反应:Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
[7].下列离子方程式正确的是
A.在氢氧化钠溶液中滴加同浓度的少量碳酸氢钙溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
B.碳酸钡跟醋酸反应:BaCO3+2CH3COOH=(CH3COO)2Ba+2H2O
C.氯气与水反应:Cl2+H2O![]() Cl-+2H++ClO-
Cl-+2H++ClO-
D.足量的氢氧化钠溶液跟碳酸氢镁溶液反应:
Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
[8].下列反应的离子方程式错误的是
A.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应: Al(OH)3+3H+→Al3++3H2O
D.过量CO2通入氢氧化钠溶液中: CO2+2OH-→CO32-+H2O
[9].下列离子方程式书写正确的是
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O
C.过量的SO2气体通入NaClO溶液中:SO2+H2O+ClO―=HClO+HSO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
[10].下列离子方程式正确的是
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
B.氧氧化钡溶液与稀硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
D.三氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH![]()
[11].对于复分解反应:X+Y=Z+W,下列叙述正确的是
A.若Z是强酸,则X和Y必有一种是酸,而不能是强酸的酸式盐
B.若Y是强碱,X是盐,则Z或W必有一种是弱碱
C.若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
D.若W是弱碱,Z是盐,则X和Y必有一种是强碱
[12].下列说法错误的是
A.盐与盐之间产生两种新盐的反应不一定是复分解反应
B.不活泼金属单质一定不能与活泼金属的盐溶液反应
C.有的低沸点酸可以制取某些高沸点酸
D.酸与酸之间有的也能发生化学反应
[13]. (2005.6江苏卷9)下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:OH-+NH![]()
![]() H2O+NH3↑
H2O+NH3↑
C.氢氧化镁与稀硫酸反应:H++OH-=H2O
D.单质铜与稀硝酸反应:Cu+2H++2NO![]() =Cu2++2NO↑+H2O
=Cu2++2NO↑+H2O
[14]. (2005.6广东卷6)下列反应离子方程式正确的是
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO![]()
C.向小苏打溶液中加入醋酸溶液:HCO![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
[15]. 能正确表示下列反应的离子方程式是
A.用铂电极电解硫酸铜溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
B.Na2S溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
[16]. (2005.6上海卷13)下列离子方程式正确的是
A.碳酸氢钠溶液中加入盐酸:CO![]() +2H+→CO2↑+H2O
+2H+→CO2↑+H2O
B.硫化亚铁与盐酸反应:S2-+2H+→H2S↑
C.苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH→C6H5OH+CH3COO-
D.氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl-
[17]. 能正确表示下列反应的离子方程式是
A.碳酸氢铵溶液中加入NaOH溶液共热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
B.用碳酸钠溶液吸收少量二氧化硫:2CO![]() +SO2+H2O=2HCO
+SO2+H2O=2HCO![]() +SO
+SO![]()
C.制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
D.硫酸镁溶液和氢氧化钡溶液反应:SO![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
[18]. 下列离子方程式中,正确的是
A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ ClO-+H2O
C.碳酸氢钠溶液跟稀硝酸反应:NaHCO3+H+=Na++H2O+CO2↑
D.氢氧化钙溶液与氢氟酸溶液混合生成白色沉淀:2HF+Ca2++2OH-=CaF2↓+2H2O
[19]. 下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH![]() +OH-=NH3↑+H2O
+OH-=NH3↑+H2O
C.NaHCO3的水解:HCO![]() +H2O
+H2O![]() OH―+H2CO3
OH―+H2CO3
D.次氯酸钙溶液中通入过量的二氧化碳气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
[20]. 下列反应的离子方程式正确的是
A.把金属铁放入稀硫酸中:2Fe +6H+=2Fe3++3H2↑
B.铜片与稀硝酸反应:Cu+NO![]() +4H+=Cu2++NO↑+2H2O
+4H+=Cu2++NO↑+2H2O
C.NaHSO3溶液呈酸性:HSO3-+H2O![]() H3O++SO32-
H3O++SO32-
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:
NH![]() +H++SO
+H++SO![]() +Ba2++2OH-=NH3·H2O+BaSO4↓+H2O
+Ba2++2OH-=NH3·H2O+BaSO4↓+H2O
[21].某溶液中含有SO42-、CO32-、OH-、Cl-,若只允许取一次该溶液而把四种离子分别检验出来,则应采取什么样的措施(能写出离子方程式的,写出每检出一种后的离子反应方程式)
(1) 先检验 ;加入 试剂。离子方程式________________________________。
(2) 然后检验 ;加入 试剂。离子方程式________________________________。
(3) 再检验 ;加入 试剂。离子方程式________________________________。
(4) 最后检验______;加入_______试剂。离子方程式________________________________。
[22].将过量的铁粉投入稀HNO3中充分反应,过滤后,往滤液中加入盐酸,在这两个过程中:
第一个反应的离子方程式是 。
第二个反应的化学方程式(注明电子转移情况以及氧化剂、还原剂)是
在滤液中加盐酸后颜色的变化是 。
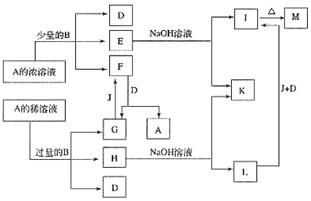 [23].A~M所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液和石炭酸溶液混合,溶液呈紫色。A~M各物质之间相互反应转化关系如下图所示(未注明必要的反应条件)。请回答:
[23].A~M所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液和石炭酸溶液混合,溶液呈紫色。A~M各物质之间相互反应转化关系如下图所示(未注明必要的反应条件)。请回答:
(1) B在A的浓溶液中反应而溶解的
条件是____________,而常温下
B在A的浓溶液中难以反应而溶解的原因是 。
(2) 写出下列化学方程式:
D+F→G+A ,
J+G→F ,
E→I的离子方程式 。
(3) L转化成I的现象是 。
(4) 常温下Cu能与B3+反应:Cu+2B3+=Cu2++2B2+。现取Cu与M混合物26.4g与1L 1mol/L
的H2SO4溶液(过量)充分反应。反应后测得溶液中B3+的浓度为0.05mol/L(溶液体积仍
可视为1L),则原固体混合物中Cu的质量是多少?反应后溶液中H+的物质的量浓度是
多少?(不考虑盐类的水解)
[1] BC 电荷守恒
[2] B
[3] AD
[4] D ①③④
[5] B
[6] D
[7] D
[8] D
[9] B
[10] CD
[11] C
A如NaHSO4+H2SO4(浓)→HCl、B如NaOH+NaHCO3或Ca(OH)2+Na2CO3、D如铝盐与氨水
[12] B
[13] B
[14] A
[15] A
[16] C
[17] B
[18] D
[19] C
[20] AC
[21] (1)OH-、NH4NO3 OH-+NH![]()
![]() NH3↑+H2O (2)CO
NH3↑+H2O (2)CO![]() 、HNO3 CO
、HNO3 CO![]() +2H+=CO2↑+H2O (3)SO
+2H+=CO2↑+H2O (3)SO![]() 、Ba(NO3)2 SO
、Ba(NO3)2 SO![]() +Ba2+=BaSO4↓ (4)Cl-、AgNO3 Cl-+Ag+=AgCl↓
+Ba2+=BaSO4↓ (4)Cl-、AgNO3 Cl-+Ag+=AgCl↓
[22] 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
9 ![]() +12HCl=5Fe(NO3)3+4FeCl3+3NO↑+6H2O
+12HCl=5Fe(NO3)3+4FeCl3+3NO↑+6H2O
【铁升1,氮降3,生成1molNO,参加反应的Fe(NO3)2为3mol,余下观察法】
Fe(NO3)2既是氧化剂又是还原剂 由绿色变为黄色
[23] (1)加热、钝化
(2)3NO2+H2O=2HNO2+NO 2NO+O2=2NO2 Fe3++3OH-=Fe(OH)3↓
(3)白色沉淀先变成灰绿色,最后变成红褐色
(4)1.25moL/L