| 非金属知识规律 |
【考试大纲要求】
1.理解非金属的概念。
2.了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型非金属(卤族元素)在周期表中的位置及与其性质的关系。了解其他常见非金属元素(如:H、O、S 、N、P、C、Si)的单质及其化合物。
【知识规律总结】
一、元素非金属性的强弱规律
1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H:
2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N>Br;而单质的活泼性:O2< Cl2,N2<Br2。
3.比较非金属性强弱的八条依据
(1)元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金属单质与氢气化合的越容易,非金属性越强。如F2、Cl2、Br2、I2 与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2 ;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2![]() CuCl2;2Cu+S
CuCl2;2Cu+S![]() Cu2S,说明非金属性Cl>S。
Cu2S,说明非金属性Cl>S。
(8)几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱,如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
二、非金属元素的化学性质(注意反应条件、现象、生成物的聚集状态)



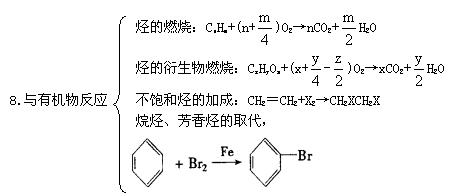
三、常见非全属单质的制取方法
1.电解法
①电解水溶液:如2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2![]() F2↑+H2↑+2KF
F2↑+H2↑+2KF
2.分解法:如2KClO3![]() 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4![]() C+2H2 2H2O2
C+2H2 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足)![]() 2H2O+2S
2H2O+2S
4.氧化法:如MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
5.还原法:C+H2O![]() CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2![]() Si+2CO↑
Si+2CO↑
【思维技巧点拨】
例1
(1)氰化钾、氰化氢的制备反应式为:K2CO3+C+2NH3![]() 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3![]() HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
氰离子为负一价(CN-),其中碳氮元素的化合价分别为________。以上两个反应是否均为氧化还原反应?(2)制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式。②为什么要磨细和用粉末?③为什么要强调适度加热?
解析 据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS![]() K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS![]() HCN↑+K2S。
HCN↑+K2S。
例2 金属M可以在不同条件下发生下列五个反应:M+A→I, M+B→H, M+C→H+F, M+D→H+A, M+E→I+G。 其中(1)A、B、C、D、E在通常情况下都是气体,并且C是CO 2。(2)上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C A +G→E,(3)I是一种离子化合物,它可以水解产生一种白色沉淀和E。该白色沉淀加热可分解为H和H2O。而E则是分子晶体,其分子中共有10个电子,根据以上条件,判断并写出 有关物质的化学式:A________,B________,C________,D________,E________,F________,G________,H________,I________,M________。
解析 本题的突破口是M+C→H+F,而C为CO2。一般同CO2能发生反应的金属就现有知识来讲,只能是Mg。F、H中有一为碳,根据F+B→C,则C为CO2,B为气体,F肯定为碳,H为MgO。扫描全题,得知E是分子晶体,且其分子中共有10个电子。分子中有10个电子的有:HF、H2O、NH3、CH4等。而E又通过一种离子化合物水解而得到,E可能为 HF或NH3。如E为HF,根据M+E→I+G,HF同Mg作用,但事实HF同Mg不反应。如为NH3同样根据A+G→E,A为N2或H2。因为Mg可跟A作用,显然A为N2,I为Mg3N2。再根据M+D→H+A,M为Mg,H为MgO,A为N2,则D只能为NO2。
A:N2,B:O2,C:CO2,D:NO2,E:NH3,F:C,G:H2,H:MgO,I:Mg 3N2,M:Mg。

【能力突破练习】
一、选择题
1.下列说法从化学角度分析,其中不正确的是( )
A.高温高压下可将石墨转变为金刚石
B.从煤焦油中可分馏出苯、甲苯、酚等有机物
C.制取镁粉时,可将镁蒸气在氮气中冷却
D.“氮的固定”是指将空气中游离的氮转变为氮的化合物的方法
2.下列叙述中正确的是( )
A.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
B.凡质子数相同的微粒,其化学性质一定相同
C.含氧酸可作氧化剂,无氧酸只能作还原剂
D.元素的非金属性越活泼,其阴离子的还原性越弱
3.地壳中含量第一和第二的两元素形成的化合物,不具有的性质是( )
A.熔点很高 B.是酸酐,与水反应生成对应的酸
C.可与纯碱反应 D.与碳在高温下反应可制取两元素中一种单质
4.在一定条件下,RO3-与R-可发生反应:RO3-+5R+6H+=3R2+3H2O下列关于R元素的叙述中,正确的是( )
A.R位于周期表中VA族 B.R的气态氧化物的水溶液是强酸
C.RO3-中的R只能被还原 D.R2在常温常压下一定是气体
5.磷酸的结构式为 ,两个磷酸分子可脱去一分子水生成焦磷酸(H4P2O7)。含磷洗衣粉中含有三聚磷酸钠(Na5P3O10),1mol此钠盐中P-O键的物质的量为( )
,两个磷酸分子可脱去一分子水生成焦磷酸(H4P2O7)。含磷洗衣粉中含有三聚磷酸钠(Na5P3O10),1mol此钠盐中P-O键的物质的量为( )
A.7mol B.8mol C.9mol D.12mol
6.在相同状况下,将下列四种混合气体:①体积比为3∶1的NH3和N2 ②体积比为 1∶1的NO2和N2 ③体积比为1∶1的NO2和O2 ④体积比为4∶1的NO2和O2,分别置于相同的四支试管中并倒置于水槽中,充分反应后液面上升高度分别为h1、h2、h3、h4,下列关系正确的是( )
A.h1>h2>h3>h4 B.h4>h3>h2>h1
C.h4>h1>h3>h2 D.h2>h3>h1>h4
7.将SO2通入BaCl2溶液至饱和未见沉淀,继续通入另一气体仍无沉淀,通入的气体可能是( )
A.CO2 B.NH3 C.NO2 D.H2S
8.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
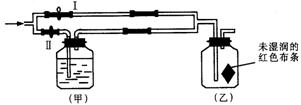
①浓H2SO4 ②NaOH溶液 ③Na2SO3溶液 ④NaCl溶液
A.② B.②③ C.①②③ D.①②④
9.有A、B、C三种气体,它们是Cl2、HCl、HBr,已知A、B混合不反应,则下面叙述正确的是( )
A.C绝不是HCl B.A、B能确定
C.C可能是HCl D.C不是Cl2,也不是HBr
10.湿润的淀粉KI试纸接触某气体而显蓝色,该气体中可能有①Cl2 ②NO2 ③H 2S ④SO2 ⑤HCl ⑥溴蒸气( )
A.①③④ B.①②⑤ C.①②⑥ D.②④⑤
二、非选择题
11.光化学烟雾(主要含有臭氧、低级醛、硝酸酯等)是二次污染物,主要由汽车尾气中的氮氧化物、碳氢化合物在日光照射下与O2反应而形成。首先NO2分解成NO和氧原子,氧原子与O2结合成O3,进行包括三个反应的产生O3的循环,请补充化学方程式②和③
①NO2 NO+O ②________________ ③________________以上三个反应总化学方程式为________________
NO+O ②________________ ③________________以上三个反应总化学方程式为________________
生成的臭氧再与汽车尾气中其它成份反应可生成醛。试写出尾气中的2-丁烯被臭氧氧化 成乙醇并释放出氧气的化学方程式________________。
12.现有A、B两种化合物,具有如下性质(S表示硫)
A+B+H2SO4→Na2SO4+S↓+H2O; A+H2SO4→Na2SO4+D↑+H2O;
B+H2SO4=Na2SO4+E↑; D+E→S↓+H2O; E+Br2→S↓+HBr
根据反应事实,推断A、B、D、E四种物质的化学式:
A________ B________ D________ E________。
13.下图为喷泉实验装置图。
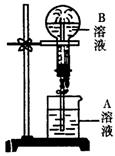
(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质(如能用有关离子表示,请写出离子符号)的名称或离子符号。
| 编号 | A溶液颜色 | B溶液颜色 | A溶液中溶质 |
| ① | 无色 | 红色 |
|
| ② | 黄色 | 棕褐色浑浊 |
|
| ③ | 红色 | 黄色 |
|
| ④ | 无色 | 乳白色浑浊 |
|
(2)若大烧瓶内充的是不易形成喷泉的含氧72.7%的XO2气体,但如果加入固体YOH 再作轻轻振荡后,则可形成喷泉。实验后取烧瓶内溶液作焰色反应,其焰色为浅紫色,则XO2的化学式为________。
14.图示各物质间的转化关系中,A、B是两种正盐,均含有同一种非金属元素,A、B溶于水后得到混合溶液①。
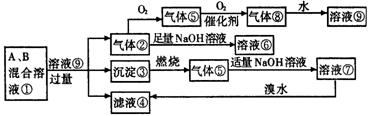
(1)写出下列反应的离子方程式:
②→⑥_____________________________________
⑦→④_____________________________________
(2)混合溶液①中的两溶质A、B可能存在多种组合,将其可能的组合中A和B的化学式及其物质的量nA、nB间应满足关系的数学表示式填入下表中(有几种情况填几种,可不填或也可补充):
| 组合 | A | B | nA与nB的关系 |
| Ⅰ |
|
|
|
| Ⅱ |
|
|
|
| Ⅲ |
|
|
|

参考答案
【能力突破练习】
1.C,2.D,3.B,4.B,5.C,6.C,7.A,8.C,9.A,10.C
11.O+O2=O3,2NO+O2=2NO2
3O2![]() 2O3,CH3CH=CHCH3+2O3
2O3,CH3CH=CHCH3+2O3![]() 2CH3CHO+2O2
2CH3CHO+2O2
12.Na2SO3 Na2S SO2 H2S
13.(1)①酚酞 ②FeCl3 ③甲基橙 ④AlCl3 (2)CO2
14.(1)H2S+2HO-=S2-+2H2O; SO![]() +Br2+H2O=SO
+Br2+H2O=SO![]() +2Br-+2H+
+2Br-+2H+
(2)Na2S,Na2SO3,![]() ; Na2S,Na2S2O3,
; Na2S,Na2S2O3,![]()