高三化学复习单元测试(2)—碱金属
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 C:12 O:16 S:32 N:14 Cu:64 Fe:56 Ag:108
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题4分,共12题)
1.(05江苏9.)下列有关钠的叙述中,错误的是
A . 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠是一种灰黑色的固体
D. 钠的质地软,可用小刀切割
2.金属钠在空气中长久放置,最终生成物是
A. Na2O2 B. Na2O C. Na2CO3 D. NaOH
3. 将a g金属钠投入到b g水中(水过量),反应后所得溶液的质量分数是
A. a/(a+b) ´100% B. 40a/ (a+b) ´100% C. 20a/(a+b) ´ 100% D. 40a/(22a+23b) ´ 100%
4. 等质量的Na2CO3、NaHCO3与足量盐酸作用,符合下列情况的是
A. Na2CO3比NaHCO3反应速率快 B. 相同条件下Na2CO3产生的CO2体积大
C. NaHCO3比Na2CO3反应剧烈 D. 两者放出CO2的体积一样
5.为确证NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是
A. 观察加热时能否放出气体
B. 观察加盐酸时能否放出气体
C. 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成
D. 溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成
6.下列反应的离子方程式书写正确的是
A. 碳酸钠溶液跟盐酸混合CO32- + 2H+ == CO2↑+ H2O
B. 碳酸氢钠溶液跟石灰水混合 HCO3- + OH- = CO32-+ H2O
C. 碳酸氢钠溶液跟氢氧化钠溶液混合 H+ + OH- = H2O
D. 金属钠投入水中Na + H2O = Na+ + OH- + H2↑
7. 在稀溶液中下列离子能共存,且加人NaOH溶液有沉淀析出,加人盐酸有气体逸出的一组是
A. Na+、SO42-、Cu2+、Cl- B. Na+、Ca2+、Cl-、HCO3-
C. K+、Na+、NO3-、CO32- D. Ca2+、K+、SO42-、CO32-
8.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液的体积无变化)
A. CH3COO- B. SO32- C. CO32- D.HCO3-
9.下列物质能使品红溶液褪色的是
①活性炭 ②过氧化钠 ③氯水 ④SO2 ⑤臭氧
A.①③④ B. ②④⑤ C.①②③④ D.①②③④⑤
10.在天平两托盘上分别放上质量相等的两只烧杯,在杯中分别加入等物质的量浓度、等体积的硫酸,些时天平处于平衡状态,然后分别向两只烧杯中加入等质量的无水碳酸钠和碳酸氢钠,最后天平两端的相对质量是
A.放NaHCO3的一端质量大 B.放Na2CO3的一端质量大
C.天平仍处于平衡状态 D.无法判断
11.向含0.14molNa2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是
A.得0.2molNaCl和0.08molNaHCO3 B.剩0.04molNa2CO3,得0.20molNaCl
C.剩0.06molHCl,得0.14molNaCl和0.14molNaHCO3D.得0.06molNaCl和0.08molNaHCO3
12. 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
A.3.38g B.4.58g C.4.16g D.4.41g
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
第Ⅱ卷(非选择题共60分)
13. (10分)往碳酸氢钠稀溶液中滴入氯化钙溶液,无沉淀产生,其原因是
;
若往上述混合溶液中加入氢氧化钠溶液,可观察到 ,
其离子方程试为 ;
在0.5mol·L:纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是:___________________________________________________
14.(10分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
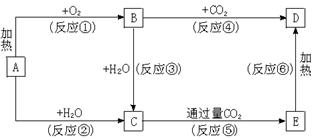
请填写下列空白:
(1)写出化学式:A________________,B________________,D________________。
(2)以上反应中,属于氧化还原反应的有____________________(填写编号)。
(3)写出E→D的化学方程式 。
15. (16分)(05全国卷I28.)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
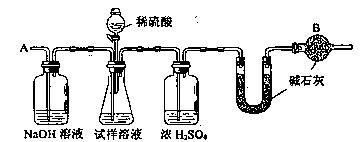
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴ 在用托盘天平称量关品时,如果天平的指针向左偏转,说明________________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________(填偏高、
偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
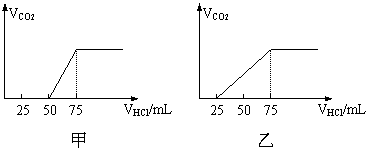 |
16. (12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,
其物质的量之比是 ,产生的CO2气体体积(标况)是 。
乙所得溶液中存在的溶质是 其物质的量之比是 ,产生的CO2气体体积(标况)是 。
17.(本题共12分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
高三化学复习单元测试(2)碱金属—参考答案
第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | C | D | C | D | A | B | A | D | B | A | C |
第Ⅱ卷(非选择题共60分)
13. Ca(HCO3)2可溶于水,有白色沉淀产生,Ca2+ + 2HCO3- + 2OH- =CaCO3 + CO32- + 2H2O;产生白色沉淀,且溶液的红色褪去,
14. (1)Na
Na2O2
Na2CO3(2)①②③④(3)2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
15. (1)样品重,砝码轻
(2)防止空气中的CO2和水气进入U型管中
(3)偏高
(4)把反应中的CO2全部导入U型管中
(5)判断反应中的CO2是否全部排出,并被U型管中的碱石灰吸收
(6)![]() ×100%
×100%
(7) 取一定量的纯碱试样,溶入适量的蒸馏水中,加入足量的BaCl2溶液,过滤、洗涤、干燥、称量滤渣(BaCO3) (或其它合理答案)
16. 解析:NaOH溶液中通入一定量的CO2,有几种情况:一种情况是CO2不足,反应后的混合物为NaOH,Na2CO3;另一种情况是二者恰好完全反应生成Na2CO3;第三种情况是CO2过量,全部NaOH转化为NaHCO3;第四种情况是CO2过量,反应后的混合物为NaHCO3和Na2CO3。
分析甲图象:加入盐酸50mL时开始产生CO2气体,至反应完毕消耗25mL盐酸,根据反应:
Na2CO3+HCl=NaHCO3+NaCl ①
NaHCO3+HCl=NaCl+H2O+CO2↑②
可知滴加到50mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入50mL以前,无气体放出,与盐酸反应转化为NaHCO3应消耗25mL盐酸,则与NaOH反应的盐酸也应是25mL。由此得也甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0.056L.
分析乙图象:加入盐酸25mL时开始产生CO2气体,消耗50mL盐酸反应完全,耗酸为末产生气体时的2倍,说明原物质是Na2CO3和NaHCO3的混合物,由耗酸量可判断出物质之比为1:1,产生气体亦可由产生气体耗酸量求得,为0.112L。
17.(1)0.006mol
(2)① n(CaO2) = 0.006mol n(Ca2+) = 0.007mol m(CaO) = 0.056g
② n(H2O) = 0.003mol X = 1/2