高三化学复习单元测试(5)—物质结构 元素周期律
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 He:4 C:12 O:16 S:32 N:14 Cl:35.5 K:39 Na:23
Ca:40 Al:27
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共16题)
1.(05广东13、)铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 。下列推断正确的是
A、Tl+的最外层有1个电子 B、Tl3+的氧化性比Al3+弱
C、Tl 能形成+3价和+1价的化合物 D、Tl+的还原性比Ag强
2.(05广东10、)短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A、X与Y不可能位于同一主族 B、X与Y一定位于同一周期
C、X与Y可能形成共价化合物XY2 D、X与Y可能形成离子化合物XY
3.(05广东5、)下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是
A、NH4Cl=NH3↑+ HCl↑ B、NH3+CO2+H2O=NH4HCO3
C、2NaOH+Cl2=NaCl+NaClO+H2O D、2Na2O2+2 CO2=2Na2 CO3+O2
4.(05广东1、)Se是人体必需微量 元素,下列有关![]() Se和
Se和![]() Se的说法正确的是
Se的说法正确的是
A、![]() Se 和
Se 和![]() Se互为同素异形体
B、
Se互为同素异形体
B、![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
C、![]() Se和
Se和 ![]() Se 分别含有44和46个质子 D、
Se 分别含有44和46个质子 D、![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
5.(05全国卷Ⅲ 9.)同一主族的两种元素的原子序数之差不可能是
A.16 B.26 C.36 D.46
6.(05全国卷Ⅱ7.)下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都有从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
7.(05全国卷I 9.)下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
8.(05全国卷I 6.)下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
9.(05江苏13.)A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.Z、 Y、X三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
10.(05北京8.)右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
 A.常压下五种元素的单质中,Z单质的沸点最高
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
11. (05江苏7.)在下列元素中,不属于主族元素的是
A 磷 B 铁 C 钙 D 碘
12.(05天津7.)下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
13.(05上海2、)有关化学用语正确的是( )
A、乙烯的最简式C2H4 B、乙醇的结构简式C2H6O
C、四氯化碳的电子式\S\UP8(.. D、臭氧的分子式O3
14.(05上海12、)下列说法错误的是( )
A、原子晶体中只存在非极性共价键
B、分子晶体的状态变化,只需克服分子间作用力
C、金属晶体通常具有导电、导热和良好的延展性
D、离子晶体在熔化状态下能导电
15.(05上海18、)下列离子中,电子数大于质子数且质子数大于中子数的是( )
A、D3O+ B、Li+ C、OD¯ D、OH¯
16.(05全国卷I 7.)等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为
A.+1 B.+2 C.+3 D.+4
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题共60分)
17.(05上海23、(B)) (16分)
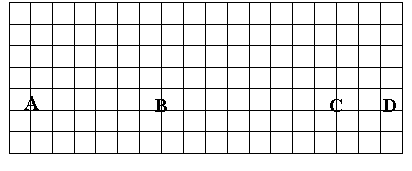
(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B
(c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
18..(05全国卷I 27.) (20分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
⑴ 丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是:
_________________________________________________。
⑵ 乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
_________________________________________________。
⑶ 在一定条件下,甲与O2反应的化学方程式是____________________________________。
⑷ 丁的元素符号是__________________,它的原子结构示意图为_____________________。
⑸ 丁的氧化物的晶体结构与_______________的晶体结构相似。
19.(16分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号:
B________________ D______________ E_______________。
(2)写出B、D两元素组成的非极性分子的电子式_____________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_____________________、________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:___________________________________________。
20. (8分)试用实验室提供的下列试剂,设计两个不同原理的简单实验(只要写出实验方案即可),证明镁元素的金属性比铝强。
试剂:Mg条,Al丝,AlCl3溶液,MgCl2溶液,稀HCl,NaOH溶液。
高三化学复习单元测试(5)—物质结构 元素周期律参考答案
第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | D | B | D | D | A | C | D | D | B | D | D | A | D | A |
17. 23、(B)(本题共8分)
| Mg | Al | ||||||||||||||||
(1)b
(2)H
(3)① 右表中
② 镁
b、c
18. (1)CaC2 +2H2O = Ca(OH)2 + C2H2↑
![]() (2)
(或其它合理答案)
(2)
(或其它合理答案)
![]() (3)
(3)
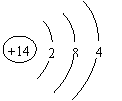
(4)Si
(5)金刚石
19. ⑴C、O、P
⑵![]()
⑶(NH4)2CO3、(NH4)3PO4、NH4HCO3、NH4H2PO4、(NH4)2HPO4等均可
⑷OH-+HCO3-=CO32-+H2O(
20. 方案一:用Mg条和Al条分别与盐酸反应,观察其反应速率的快慢。
方案二:用Mg条和Al条分别与NaOH溶液反应,观察能否反应,能与碱溶液反应者显两性,金属性比 Mg弱。
方案三:分别向AlCl3溶液、MgCl2溶液中加入NaOH溶液,观察其沉淀及其沉淀溶解情况。
方案四:将Mg条和Al丝靠在一起,插入稀HCl中,观察其气泡产生情况。