北京市东城区2004—2005学年度第一学期期末教学目标检测
高三化学
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 分数 |
考生须知:本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,将第I卷选
择题的答案答 “答题卡”上。第II卷直接答在试卷上。
2、将学校、姓名、准考证号填在密封线内,若填在线外,试卷作废。
有关的相对原子质量:H:1 C:12 O:16 Na:23 K:39 Cu:64
第I卷(72分)
一、选择题(本题包括9小题,每小题4分,共36分,每小题只有一个选项符合题意)
1、下列关于臭氧性质的叙述中不正确的是 ( C )
A.臭氧的氧化性比氧气的强,常温能将Ag、Hg等不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C.臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂
D.臭氧和氧气在一定条件下可以相互转化
2、下列化合物中,既有离子键,又有共价键的是 ( D )
A.CaO B.SiO2 C.H2O D.Na2O2
3、在2CH4(g)+2NH3(g)+3O2(g)![]() 2HCN(g)+6H2O(g)反应中,已知
2HCN(g)+6H2O(g)反应中,已知
v(HCN)=n mol /(L·min),且v(O2)=m mol /(L·min),则m与n的关系正确的是 (C )
A.m=1/2n B.m=2/3n C.m=3/2n D.m=2n
4、2003年10月15日我国成功发射了第一艘载人航天飞船-“神州五号”。从此我国进入了航天大国和航天强国行列。发射“神五”用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol。
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol。下列关于肼和NO2反应的热化学方程式中,正确的是 ( D)
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000。3 kJ/mol
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
5、汽车的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是 ( B)
A.Pb O2是电池的负极 B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 ↓
![]() C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
6、从柑橘中可提炼得到一种有机物,(其结构如图
)下列关于它的说法不正确的是 (D )
A.分子式为C10H16 B.其一氯代物有8种
C.能与溴水发生加成反应 D.难溶于水,且密度比水大
7、一定温度下,某在物质水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是 ( C)
①溶液中溶质的摩尔质量②溶液中溶质和溶剂的质量比③溶液的密度④溶液的体积 A.① ② B。② ③ C.①③ D. ②④
8、下列实验方案合理的是 ( B )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
C.用加热法分离I2和NH4Cl 的混合物
D.为了加更快得到氢气,可以用纯锌代替粗锌
9、 实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为 ( C )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
二、选择题(本题包括9小题,每小题4分共36分,每小题一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10、液氨溶解金钠属后成为蓝色的导电能力很强的溶液,其颜色被认为是电子的氨合
e-(NH3)n引起的。若放置后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠(NaNH2),反应的化学方程式为:2Na+2 NH3=NaNH2+H2↑,下列说法中不正确的是 ( C)
A.溶液褪色的速率与逸出氢气的速率成正比
B.液氨中有如下平衡:2NH3=NH4++NH2-
C.液氨是一种非电解质,在水中才能电离
D.碱金属的液氨溶液是一种强还原剂
11、下列离子方程式书写正确的是 ( AD )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
B.氯化铝溶液中加入过量的氨水
Al3++4 NH3·H2O=4NH4++AlO2-+2H2O
C.向次氯酸钙溶液中通入少量的二氧化硫
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.碳酸钠溶液中加入过量的苯酚
-OH+CO32-
=![]() -O-+HCO3-
-O-+HCO3-
12![]() 、 NA代表阿伏加德罗常数,下列说法正确的是
( B )
、 NA代表阿伏加德罗常数,下列说法正确的是
( B )
A.1L浓度为0.1 mol / L AlCl3溶液中含有的离子数是0.4NA
B. 3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
C.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
D.标准状况下,1.12L的SO3所含的原子数是0.2 NA
| X | Y |
|
| Z | W |
13、X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是
(BD )
,下列说法中正确的是
(BD )
A.阴离子的半径从大到小排列顺序为:X>Y>Z>W
B.X元素的氢化物分子间可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
14、一定条件下,可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol /L,0.3mol/ L,0.08 mol/L,则下列判断不合理的是
(C )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol /L,0.3mol/ L,0.08 mol/L,则下列判断不合理的是
(C )
A.c1:c2=1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0< c1<0.14 mo /L
15、向0.1 mol / L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起 ( A )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c(OH-)减小
16、对于某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+),分别进行如下实验:
① 加热时放出的气体可使品红溶液褪色;
② 加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③ 加入氯水时,溶液略呈黄色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是 ( B )
A.Br- B.SO42- C.H2SO3 D.NH4+
17、维生素B2也称“核黄素”,其结构如下图。维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病。下列有关维生素B2的说法中正确的是 ( C )
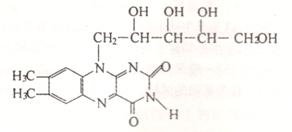
A. 核黄素晶体属于离子晶体
B. 核黄素能发生银镜反应
C. 核黄素能被酸性高锰酸钾溶液氧化
D.核黄素能与氯化铁溶液作用呈紫色
18、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI+3H2O![]() KIO3+3H2↑。下列有关说法正确的是
(BD)
KIO3+3H2↑。下列有关说法正确的是
(BD)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变
第Ⅱ卷(78分)
三、(本题包括2小题,共16分)
19、(5分)现用已知物质的量的浓度为a mol/L的标准盐酸去测定V mL的NaOH溶液的物质的量的浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是__________________________.
(2)下图是酸式滴定管中液面在滴定前后的读数:
![]()
![]()
| ||||
| ||||
滴定前 滴定后
c(NaOH)= _________________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量的浓度会偏_____。
20、(11分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
|
|
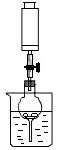
|
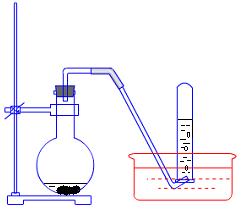
I Ⅱ
(1)铜与稀硝酸反应的离子方程式____________________________________________________。(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO 气体__________(填“能”或“不能”),简述理由___________________________________________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是_____________________________________________________________________________;在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_________________________________________________________________________________________________。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是____________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是______________________。
四、(本题包括2小题,共20分)
21、(8分)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是_________________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,,有关反应的离子方程式是_____________________________________________。从以上事实可知,ClO-、I2、SO42-的氧化性由弱到强的顺序是_____________________________。
22、(12分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B=H++HB-
HB- ![]() H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显___________(填“酸性”,“中性”,或“碱性”)。
理由是 (用离子方程式表示)
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是_________。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B. .c (Na+)+c(OH-)=c(H+)+c(HB -)
C.c (Na+)+c(H+)=c(OH-)+c(HB -)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/ LH2B溶液中氢离子的物质的量浓度可能是 0.11 mol/L(填“<”,“>”,或“=”),理由是:
。
(4)0.1 mol/L NaHA溶液中各种离子浓度由大到小的顺序是________________________________。
五、(本题包括2小题,共26分)
23、(10分)烃A1、A2互为同分异构体,它们各加1molH2都可得到烃B。A1、A2各加1molHCl都得到C1。而B在光照下与氯反应,只得到两种一氯代烃C1和C2。B中碳的质量分数为83.7%。
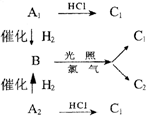
则 A1、A2、B和C1、C2的结构简式分别是
A1_________________,A2_________________,
B__________________,C1___________________,C2________________。
24、(16分)2004年是俄国化学家马尔柯夫尼柯夫(V.V.Markovnikov,1838-1904)逝世100 周年。马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
|
![]() 已知:CH3CH2CN CH3CH2COOH
已知:CH3CH2CN CH3CH2COOH
以下是某有机物F的合成路线,请填写下列空白。
|
|
![]()
|
|
|
|
![]()
|
![]()
![]() -CH=CH2
C
D
-CH=CH2
C
D
![]()
(1)写出下列物质的结构简式A___________________,C___________。
(2)反应①的反应类型是____________,反应②的反应类型是____ _________。
(3)写出 ③的化学方程式_____________________________________________。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的取代基处于对位)的酯类的结构简式:
六、(本题包括2小题,共16分)
25、NaHCO3和 KHCO3的混合物6.2g与100mL 盐酸恰好完全反应,得到标准状况下CO2的体积为1.568L。
求(1)混合物中NaHCO3的质量是多少?
(2)盐酸的物质的量的浓度是多少?
|
26、(10分)已知可逆反应CO+H2O(g)![]() CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=![]() ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2 mol/ L,c(H2O)=3 mol/ L,平衡时CO的转化率为
60%,水蒸气的转化率为____________ ;K值为____________。
(2)830K时,若只将c(H2O)的起始浓度改为6 mol/ L,则水蒸气的转化率为___________。
(3)若830K时,起始浓度c(CO)=a mol/ L,c(H2O)=b mol/ L,H2的平衡浓度
c(H2)=c mol/ L,
①a、b、c之间的关系式是__________________________;
②当a=b时,a=_______c.。
北京市东城区2004~2005学年度第一学期期末教学目标检测
高三化学参考答案及评分标准
一、选择题(每小题4分,共36分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | C | D | B | D | C | B | C |
二、选择题(每小题4分,共36分)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | AD | B | BD | C | A | B | C | BD |
三、(本题包括2小题,共16分)
19、(5分)(1)(1分)用已知物质的量的浓度的标准盐酸润洗2到3次
(2)(2分)![]() mol/L
mol/L
(3)(2分)高;
20、(11分)(1) (2分)3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
(2)(2分)不能,因为圆底烧瓶中有空气,空气中的氧气会与NO反应生成NO2 ,出现红棕色。
(3)(5分)关闭止水夹,将干燥管放入带有水的烧杯中,若干燥管内的液面比烧杯中的液面低,且过一段时间后干燥管内的液面不下降,则表明该装置的气密性良好;铜片溶解,且表面有无色气泡产生,溶液变成蓝色,液面下降;有红棕色气体产生。
(4)(2分)防止污染环境。
四、(本题包括2小题,共20分,每空2分)
21、(8分)ClO-+2I-+2H+=I2+Cl-+H2O;
,SO32-+I2+H2O=SO42-+2H++2I-,SO32-、I2、ClO-
22、(12分)(1)碱性 B 2-+H2O![]() HB-+OH-
HB-+OH-
(2)CD
(3) 小于, H2B第一步电离产生的H+,抑制了HB-的电离
(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
五、(本题包括2小题,共26分,每空2分)
23、(10分, 每空2分)
A1:(CH3)2C=C(CH3)2 A2:(CH3)2CHC=CH2(A1和A2可以互换)
│
CH3
B: (CH3)2CHCH(CH3)2
C1:(CH3)2CHC(CH3)2 C2:(CH3)2CHCHCH2Cl
│ │
Cl CH3
![]() 24、(16分,每空2分)
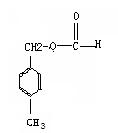
24、(16分,每空2分)
(1)CH3CH-CH2, -CH-CH3
Cl CN
![]()
![]()
![]()
![]()
![]()
![]() (2)加成反应,水解反应 CH3
CH3
CH3
(2)加成反应,水解反应 CH3
CH3
CH3
![]() (3)CH3CH-CH3+
-CH-COOH
- CH-COO-CH- CH3
(3)CH3CH-CH3+
-CH-COOH
- CH-COO-CH- CH3
OH
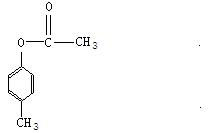 (4)
(4)
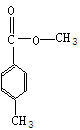
六、(本题包括2小题,共16分)
25、(6分)(1)解:NaHCO3 ~ HCl ~ CO2
1 1 1
n (NaHCO3) n (HCl) n (CO2)
KHCO3 ~ HCl ~ CO2
1 1 1
n (KHCO3) n (HCl) n (CO2)
84 g/mol* n (NaHCO3)+100 g /mol* n (KHCO3)=6.2 g ………………………(1分)
n (NaHCO3) + n (KHCO3)= 1.568L/ 22.4L/mol……………………………………..(1分)
n (NaHCO3)=0.05 mol n (KHCO3) =0.02 mol………………………………(2分)
m(NaHCO3)= 84 g/mol×0.05 mol=4.2g ………………………………………………..(1分)
c(HCl)=n (HCl)/V(HCl)=0.07mol/0.1L=0.7mol/L………………………………………..(1分)
26、(10分,每空2分)
(1)
CO+H2O(g)![]() CO2+H2
CO2+H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=![]() =1
=1 ![]() (H2O)=
(H2O)=![]() =40%
=40%
(2)设CO的转化浓度为x CO+H2O(g)![]() CO2+H2
CO2+H2
起始浓度(单位均为mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2-x 6-x x x
K=![]() =1, x=1.5mol/L
=1, x=1.5mol/L
![]() (H2O)=
(H2O)=![]() 25%
25%
(3)
CO+H2O(g)![]() CO2+H2
CO2+H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a-c b-c c c
①![]() =1
=1
② a=b ,则a=2c