黄冈中学2006届高考第一轮化学
单元训练题(五) 元素周期律 元素周期表
命题:刘道芬 审稿:罗丹校对:刘道芬
本试卷分第Ⅰ卷和第Ⅱ卷两部分 共100分,考试时间100分钟
可能用到的相对原子质量:H:1 C:12 O:16 Li:7 Na:23 K:39 Rb:85 Cs:133
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,共10分,每小题只有一个选项符合题意)
1.科学界最近发现两种粒子,第一种只由四个中子构成,被称为“四中子”,也有人称“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法中,不正确的是( )
A.四中子”不显电性
B.“四中子”的质量数为4
C.第二种粒子是氧元素的另一种同位素
D.第二种粒子的化学式为O4
2.美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种新粒子是由3个氢原子核(只有质子)和2个电子构成。对于这种粒子,下列说法中正确的是( )
A.是氢的一种新的同分异构体 B.是氢的一种新的同位素
C.化学式为H3 D.它比一个普通H2分子多一个氢原子核
3.下列各组关系中不正确的是( )
A.同分异构体:乙醇与乙醚
B.同位素:H、D、T
C.同素异形体:金刚石、石墨、C60
D.同系物:分子式为CnH2n+2的一切物质
4.下列事实与氢键有关的是( )
A.水加热到很高温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O == 4NaOH+O2↑
B.CaC2+2H2O→Ca(OH)2+CH≡CH↑
![]() C.Mg3N2+6H2O
== 3Mg(OH)2↓+2NH3↑
C.Mg3N2+6H2O
== 3Mg(OH)2↓+2NH3↑
D.NH4Cl+NaOH NaCl+NH3↑+H2O
二、选择题(本题包括8小题,每小题3分,共24分,每小题有—个或两个选项符合题意)
6.科学家最近制造出第112号元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该元素的叙述中正确的是( )
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277:12
7.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
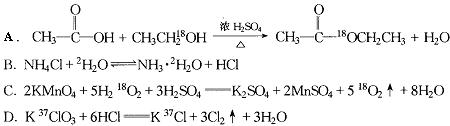
8.第三周期元素X,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X的单质在固态时一定属于原子晶体
C.X元素在常温下稳定存在的氧化物一定能与烧碱反应
D.X的单质一定是良好的半导体材料
9.周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),如Li—Mg,Be—A1,B—Si等两两性质相似。现用电解熔融LiCl的方法可得锂和氯气;若用已潮解的LiCl加热蒸干至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是( )
A.无色气体为电解生成的锂与水反应放出的H2
B.电解前LiCl在加热时已发生水解
C.电解时产生的无色气体是H2
D.无色气体是阳极放出的Cl2与水作用生成的O2
10.在一定条件下发生如下反应:RO3n-+2R2-+6H+ === 3R+3H2O,下列关于R的叙述中正确的是( )
A.R原子最外层上有6个电子 B.RO3n-中的R只能被还原
C.HnRO3是强酸 D.R的单质既具有氧化性又具有还原性
11.已知主族元素A、B、C、D的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数 a>b>c>d
B.离子半径C(n+1)->Dn->Bn+>A(n+1)+
C.单质还原性B>A,单质氧化性D>C
D.离子还原性A(n+1)+>Bn+,离子氧化性C(n+1)- >Dn-
12.A、B、c、D是四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列比较中不正确的是( )
A.原子序数:A>B>C>D B.原子半径:D>B>C>A
C.单质熔点:D>B>C>A D.简单离子半径:C>A>D>B
13.某短周期金属元素M的碳酸的正盐与其酸式盐的混合物中,二者的物质的量之比为2:3,取一定量的混合物与足量的盐酸反应,消耗的H+与产生的CO2的物质的量之比为5:4,则下列叙述中正确的是( )
A.该金属可能为ⅡA族元素
B.若该金属为第三周期元素,则对应的单质能够与CO2反应
C.若该金属为第三周期元素,则氧化物化学式可能为M2O2或M2O
D.若该金属为第三周期元素,则对应的碳酸的正盐的稳定性比Na2CO3强
三、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意)
14.a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为![]() ,下列比较中,正确的是( )
,下列比较中,正确的是( )
A.原子半径a>c>b B.原子的氧化性a>c>d
C.最高价氧化物的熔点a>d>b D.最高价含氧酸的酸性c>d>a
15.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象,试判断下列哪组原子均可产生NMR现象()
A.18O、31P、119Sn
B.27A1、19F、12C
C.元素周期表中VA族所有元素的原子
D.元素周期表中第一周期所有元素的原子
16.元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.X和Y一定不属于同一主族
B.X和Y可能属于同一周期,也可能属于两个不同周期
C.XY3晶体一定是离子晶体
D.若Y的原子序数为m,X的原子序数一定是m±4
17.X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子总数比Y元素原子的核外电子总数少5个,则X、Y可形成的化合物是( )
①离子化合物Y(XO3)2 ②离子化合物Y3X2 ③离子化合物Y2X3
④共价化合物XY2
A.①② B.②③ C.③④ D.①④
18.运用元素周期律,判断以下说法,其中不正确的是( )
A.Be是一种轻金属,它的氧化物对应水化物是两性氢氧化物
B.砹(At)是一种有色固体,HAt不稳定,AgAt是有色难溶于水和HNO3的物质
C.H2Se是无色气体,它比H2S稳定,H2SeO4是强酸
D.SrSO4可能难溶于水和强酸,Sr(OH)2应为强碱
第Ⅱ卷(非选择题,共51分)
四、(本题包括2小题,共12分)
19.(6分)在下列各元素组中,除一种元素外,其余可以按某种共性归属一类。请选出各组例外元素,并将该组的其他元素的可能归属,按所给六种类型的编号填入表内:
| 元素组 | 例外元素 | 其他元素所属类型编号 |
| (a)S、N、Na、Mg | ||
| (b)P、Sb、Sn、As | ||
| (c)Rb、B、Te、Fe |
归属类型:(1)主族元素(2)过渡元素(3)同周期元素(4)同主族元素(5)金属元素(6)非金属元素
20.(6分) 下表是元素周期表的一部分。
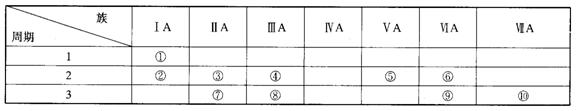
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)某元素原子的核外L层电子数比K层电子数多3个,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式: ,又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。
五、(本题包括2小题,共14分)
21.(7分) A、B、C、D均为短周期元素,A和B同周期相邻,A和C同主族相邻,三种元素的原子序数之和为31;D元素与A、B、C三元素既不同周期,也不同族。请回答:
(1)元素符号A: ,B. ,C. ,D. 。
(2)A、B、D可组成化学式D4B2A3的离子化合物,其水溶液pH<7,原因是(用离子方程式表示) 。
(3)B、D形成的化合物液态时可发生电离,其电离方程式为 ;电离得到的阳离子的电子式为 。
22.(7分)有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢外最轻的气体。
④G是除氢外原子半径最小的元素。
(1)A的名称是 ;B位于周期表中第 周期,第 族;C的原子结构示
意图是 。
(2)E的单质颜色是 。
(3)A元素与D元素形成化合物的电子式是 。
(4)G的单质与水反应的化学方程式是 。
(5)F的元素符号是 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ;酸性最强的化学式是 ;气态氢化物最稳定的化学式是 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的化学方程式是 。
六、(本题包括2小题,共12分)
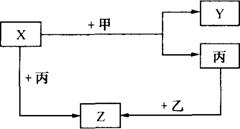 23、(6分) 如图所示,甲、乙、丙是三种常见单质,X、Y、Z是三种常见的化合物,它们之间有如下转化关系:
23、(6分) 如图所示,甲、乙、丙是三种常见单质,X、Y、Z是三种常见的化合物,它们之间有如下转化关系:
(1)若甲是具有还原性的单质,X、Y、Z中有一种是离子晶体,则:
①X、Y、Z中含有丙元素的是 (填代号);
②乙的化学式是 ;
③X与甲反应的化学方程式是 。
(2)若甲是具有氧化性的单质,丙在通常状况下呈液态,Y和Z具有相同的阳离子,则X与足量的甲在溶液中完全反应的离子方程式是 。
24.(6分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出下表所示的表格(部分)。
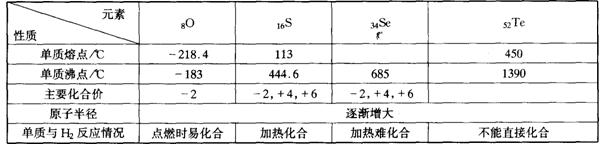
请回答下列问题:
(1)硒的熔点范围可能是 。 (2)碲的化合价可能有 。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+( )→Al(OH)3↓+ H2Te↑
(6)如图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔE为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。
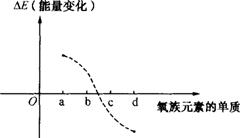 则:b代表 ,d代表 (均写单质名称)。
则:b代表 ,d代表 (均写单质名称)。
七、(本题包括2小题,共13分)图5—2
25.(4分)设X、Y、z代表三种元素。已知:
①x’和Y一两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子
核内质子数少9个;③Y和Z两种元素可以形成4核42个电子的负一价阴离子。据此,请填空:
(1)Y元素是 ;Z元素是 。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是 。
26、(9分) 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量的盐酸完全反应,放出CO2体积为1.344L(标准状况),另取
等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g。
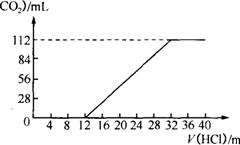 (1)取过滤后的滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol·L-1盐酸,并同时记录放出CO2体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。试计算确定这两种碱金属碳酸盐的化学式。
(1)取过滤后的滤液的1/10体积,向其中缓慢滴加浓度为0.2500mol·L-1盐酸,并同时记录放出CO2体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。试计算确定这两种碱金属碳酸盐的化学式。
(2)将滤出的不溶性盐(1.420g)投入到浓度为2.5mol/L盐酸中,完全反应时,耗去盐酸16.00mL,试计算确定原不溶性碳酸盐化学式。
单元训练题(五)参考答案
1.C 2.D 3.A 4.B 5.A 6.BD 7.AC 8.C 9.B 10.AD
11.BC 12.AC13.AB 14.D 15.C 16.B 17.A 18.C
19.
| (a) | N | (3) |
| (b) | Sn | (4) |
| (c) | Fe | (1) |
20.(1)HCl;弱 (2)N
![]()
(3)H、O、S (4)Be(OH)2+2NaOH=Na2BeO2+2H2O;Li
![]() 21.(1)O;N;S;H (2)NH4+H2O
21.(1)O;N;S;H (2)NH4+H2O
![]() NH3·H2O+H+
NH3·H2O+H+
![]() (3)NH3+NH3
(3)NH3+NH3![]() NH4++NH2-
NH4++NH2-
22.(1)钠;三;ⅡA; (2) ;紫黑色
![]() (3)
(4)2F2+2H2O
= 4HF+O2
(3)
(4)2F2+2H2O
= 4HF+O2
(5)He (6)NaOH;HbrO4;HF (7)Al(OH)3+NaOH == NaAlO2+2H2O
23.(1)①X、Z ②O2 ③CO2+2Mg![]() 2MgO+C
2MgO+C
(2)2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 6Cl- + 2Br2
24.(1)113℃~450℃ (2)-2,+4,+6 (3)H2Te>H2Se>H2S
(4)还原;2H2Se+O2 == 2H2O+2Se
(5)Al2Te3+6H2O == 2Al(OH)3↓+3H2Te↑ (6)硫;碲
25.(1)Cl;O (2)KClO4
26.(1)K2CO3、KHCO3 (2)Mg2(OH)2CO3