高考化学模拟练习
2005.12
学校________ 班级________ 姓名________
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页,第Ⅱ卷4至8页,共100分.考试时间120分钟.答题时请将第Ⅰ卷每小题答案选出后,填在第4页答卷表格的相应空格中,若仅答在题纸上则不给分.请将第Ⅱ卷各题的答案直接答在试卷的相应位置上.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Al 27 S 32 Fe 56 Cu 64
第Ⅰ卷(选择题 共40分)
一、选择题(本题包括20小题,每小题2分,共40分.每小题只有一个选项符合题意.)
1.下列产品的使用不会对环境造成污染的是( )
A.含磷洗衣粉 B.氢气 C.含汞电池 D.煤
2.下列各组中,互为同位素的是( )
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.
C.![]() 和
和![]() D.
D.![]() 和
和![]()
3.居里夫人发现了放射性元素镭(![]() ),该元素含有的中子数为( )
),该元素含有的中子数为( )
A.88 B.138 C.226 D.314
4.仅用蒸馏水,不能鉴别的一组物质是( )
A.苯和四氯化碳 B.溴蒸气和二氧化氮
C.碘和高锰酸钾 D.葡萄糖和蔗糖
5.下列物质的保存方法正确的是( )
A.少量金属钠保存在冷水中 B.浓硝酸盛放在无色试剂瓶中
C.少量白磷保存在煤油中 D.氢氧化钠溶液盛放在橡胶塞的试剂瓶中
6.下列除杂质的方法不正确的是( )
A.氢氧化铁胶体中的铁离子和氯离子用渗析法除去
B.氯化钠中混有少量氯化铵,加过量的烧碱溶液后加热蒸干
C.乙酸乙酯中混有少量乙酸,用饱和碳酸钠溶液洗涤后分液
D.硬脂酸钠溶液中混有少量甘油,用盐析法除去
7.下列反应的离子方程式书写正确的是( )
A.二氧化硫通入溴水使其褪色![]()
B.氯化铝溶液中加入过量的氨水![]()
C.小苏打溶液中滴加醋酸溶液![]()
D.明矾溶液加热水解生成沉淀![]()
![]()
![]()
8.下列事实不能用勒夏特列原理解释的是( )
A.钢铁在潮湿的空气中容易生锈
B.将氯化铝溶液加热蒸干最终得到三氧化二铝固体
C.不考虑其它因素时高压有利于工业合成氨
D.打开汽水瓶时,有大量气泡溢出
9.据报道,全氟辛酸铵是在生产不粘锅涂层材料——特富龙(化学成分为聚四氟乙烯)过程中使用的一种加工助剂,可能对人体有害.下列有关特富龙和全氟辛酸铵的说法正确的是( )
A.二者均属于无机物
B.二者均属于混合物
C.前者属于有机高分子化合物,后者属于无机酸铵盐
D.前者属于有机高分子化合物,后者属于有机酸铵盐
10.某学生课外活动小组利用下图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液颜色变为红色,冷却后恢复无色,则原溶液可能是( )
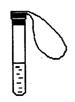
A.溶有![]() 的品红溶液
的品红溶液
B.溶有![]() 的酚酞溶液
的酚酞溶液
C.溶有![]() 的酚酞溶液
的酚酞溶液
D.溶有![]() 的品红溶液
的品红溶液
11.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.下列说法不正确的是( )
A.淀粉和纤维素均可用![]() 表示,因此它们互为同分异构体
表示,因此它们互为同分异构体
B.淀粉水解的最终产物能发生银镜反应
C.蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水
D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠
12.某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去.则该有机物可能是( )
A.乙醇 B.乙醛 C.乙酸 D.甲酸乙酯
13.下列关于砹(![]() )及其化合物的说法中,正确的是( )
)及其化合物的说法中,正确的是( )
A.稳定性:HAt>HCl
B.氧化性:![]() >
>![]()
C.![]() 为分子晶体
为分子晶体
D.NaAt的水溶液呈碱性
14.若![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.84 g![]() 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03![]()
B.a g![]() 和
和![]() 的混合气体中所含分子数一定为
的混合气体中所含分子数一定为![]()
C.1.8 g ![]() 含有的质子数为
含有的质子数为![]()
D.标准状况下,2.24 L四氯化碳含碳原子数为0.1![]()
15.某温度下,饱和KCl溶液的密度为1.17 g·![]() ,其中KCl的质量分数为25.4%,则该温度下,KCl的溶解度为( )
,其中KCl的质量分数为25.4%,则该温度下,KCl的溶解度为( )
A.46.0 g B.34.0 g C.25.4 g D.21.7 g
16.将反应![]() 配平后,
配平后,![]() 的化学计量数为( )
的化学计量数为( )
A.8 B.10 C.14 D.30
17.常温下,pH=2的盐酸与pH=13的氢氧化钠溶液,按体积比9∶1混合后的溶液pH为( )
A.12 B.11 C.7 D.3
18.已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,下列说法不正确的是( )
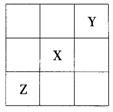
A.Y、Z的原子序数之和可能为2a
B.Y的原子序数可能是a-17
C.Z的原子序数可能是a+31
D.X、Y、Z一定都是短周期元素
19.常温下,醋酸与氨水等体积混合后,溶液的pH=7,则下列离子浓度的比较正确的是( )
A.![]() >
>![]() >
>![]() =
=![]()
B.![]() >
>![]() >
>![]() =
=![]()
C.![]() =
=![]() >
>![]() =
=![]()
D.![]() >
>![]() >
>![]() >
>![]()
20.下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
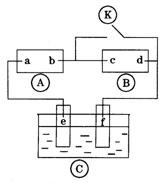
A.a为直流电源的负极
B.c极发生的反应为![]()
C.f电极为锌板
D.e极发生还原反应
第Ⅱ卷(非选择题 共60分)
二、实验与问答题(本题包括6道小题,共50分)
21.(4分)某溶液由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子组成.取适量该溶液进行如下实验:
中的若干种离子组成.取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氨水,产生白色沉淀,过滤;
③在②所得滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④在③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀.
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是_________________________________________;
(2)原溶液中一定存在的离子是___________________________________________.
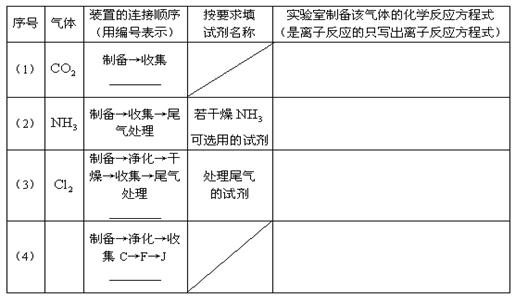
22.(10分)某校化学课外小组同学组装了下列仪器,欲经过简单连接,制备中学化学的几种常见气体.
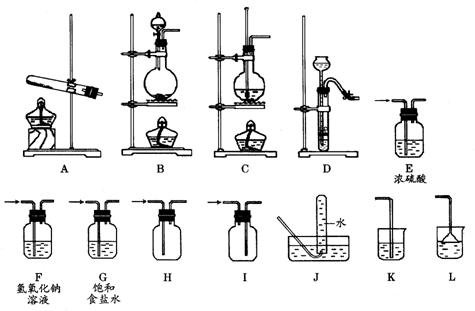
请填写下列表格中的空白处:
23.(10分)感光性高分子又称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料.其结构简式为:
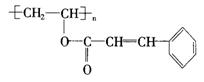
试回答下列问题:
(1)在一定条件下,该高聚物可发生的反应有(填写编号)_______________;
①加成反应 ②氧化反应 ③消去反应 ④酯化反应 ⑤卤代反应
(2)该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物为A,则
①A的分子式是__________________;
②A在一定条件下与乙醇反应的化学方程式是_______________________;
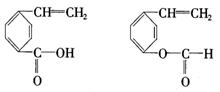
③A的同分异构体有多种,其中含有苯环、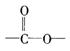 和
和![]() ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是
_________________________________、____________________________________.
24.(6分)在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300![]() ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g)![]() 2C(g);DH=-180 kJ·
2C(g);DH=-180 kJ·![]()
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·![]() ·
·![]() ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是________.
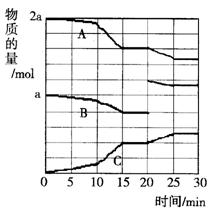
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
25.(10分)A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,B和C的原子序数之和是A的原子序数的3倍,B和C形成的离子具有相同的电子层结构.试回答下列问题:
(1)C离子的结构示意图是___________________;由A和B形成的含有非极性键的离子化合物的电子式是___________________;
(2)B离子半径(填“<”或“>”![]() ________C离子半径,B和C元素最高价氧化物的水化物之间反应的离子方程式为___________________________________________;
________C离子半径,B和C元素最高价氧化物的水化物之间反应的离子方程式为___________________________________________;
(3)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式:
__________________________________________________________________________.
26.(10分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态.其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合.有关的转化关系如下图所示(反应条件均已略去).
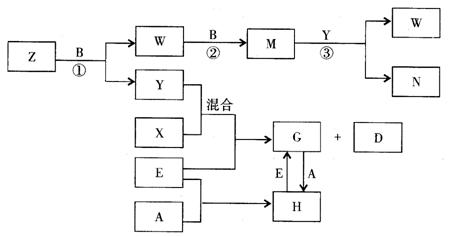
回答下列问题:
(1)A的化学式为_______________;
(2)写出反应③的化学反应方程式___________________________________________;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_______________________________________;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×![]() ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
(5)将Z与N反应后的产物溶于水中,则溶液的pH(填“<”或“>”![]() ________7,其原因是________________________________________________________________.
________7,其原因是________________________________________________________________.
三、计算题(本题包括2道小题,共10分)
27.(4分)欲测定某铝铜合金的组成,进行了如下实验:
称取粉末状样品1.0 g,量取某浓度的盐酸20 mL,第一次往样品中加入盐酸10 mL,收集到标准状况下的气体224 mL.然后,再往样品中加入盐酸10 mL,又收集到标准状况下的气体112 mL.试求:
(1)所取盐酸的物质的量浓度;
(2)样品中铝的质量分数.
28.(6分)已知反应:![]()
![]()
(1)将24 g铁粉和8 g硫粉混合均匀,在隔绝空气条件下加热使之充分反应.然后往反应产物中加入足量稀硫酸,产生气体的体积在标准状况下(忽略气体的溶解)为___________L;若使该气体完全燃烧,消耗标准状况下空气的体积为(空气中![]() 的体积分数为0.20)___________L.
的体积分数为0.20)___________L.
(2)将a g铁粉和b g硫粉混合均匀,在隔绝空气条件下充分加热.然后往反应产物中加入足量稀硫酸,将产生的气体完全燃烧,消耗标准状况下的空气V L,则V的取值范围是___________________________________.
参考答案
(注:凡其它合理答案均可酌情给分)
一、选择题(本题包括20小题,每小题2分,共40分).
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | B | D | D | B | C | A | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | C | C | B | C | B | D | C | B |
二、实验与问答题(共50分)
21.(共4分,每空2分,答对2个得1分)
(1)![]() 、
、![]() 、
、![]()
(2)![]() 、
、![]() 、
、![]() 、
、![]()
22.(共10分,每空1分)
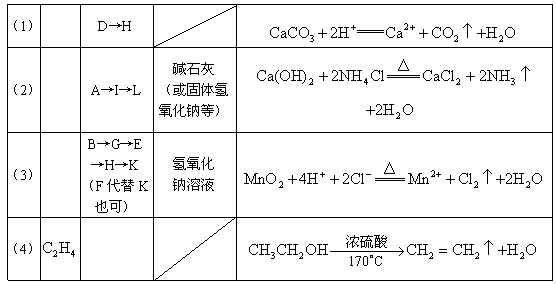
23.(共10分,每空2分)
(1)①②⑤(对2个得1分) (2)![]()
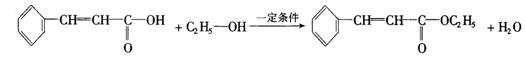
(3)
24.(共6分,每空2分)
(1)0.25 mol·![]() ·
·![]() (2)75 (3)AD
(2)75 (3)AD
25.(共10分,每空2分)
(1)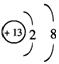 ,
,![]()
(2)>, ![]()
(3)![]()
26.(共10分,除注明1分外,其余每空2分)
(1)![]() (1分)
(1分)
(2)![]() ;
;
(3)![]() ;
;
(4)14
(5)<;(1分)
在溶液中![]() 电离出的
电离出的![]() 发生水解:
发生水解:![]()
![]()
![]() 使溶液呈酸性,故溶液的pH<7.
使溶液呈酸性,故溶液的pH<7.
三、计算题(共10分)
27.(共4分,每问2分)
(1)2 mol·![]()
(2)27%
28.(共6分,每空2分)
(1)9.6; 52.
(2)a<V≤3a(或:a<V≤5.25b![]()