新教材高考化学模拟试题精编详解(2)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.可能用到的相对原子质量:Cu∶64 C∶12 H∶1 O∶16 N∶14
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)1.控制城市空气污染源的方法可以采用( )
A.使用燃油机 B.绿化城市
C.出门戴口罩 D.开发使用太阳能
2.钋(![]() )原子核内的中子数与核外电子数之差是( )
)原子核内的中子数与核外电子数之差是( )
A.40 B.168
C.126 D.42
3.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比![]() 的关系如图所示,则X,Y的反应方程式可表示为( )
的关系如图所示,则X,Y的反应方程式可表示为( )
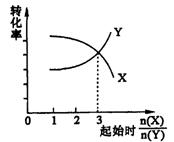
A.2X+Y![]() 3Z B.3X+2Y
3Z B.3X+2Y![]() 2Z
2Z
C.X+3Y![]() Z D.3X+Y
Z D.3X+Y![]() Z
Z
4.血液中有一种含铜呈蓝色的蛋白质分子,其相对分子质量约为151000,已知该分子中铜的质量分数为0.34%,则平均每个含铜蛋白质分子中的铜原子数为( )
A.8 B.6
C.4 D.2
5.紫杉醇是一种新型抗癌药,其分子式为![]() ,它是由如下的A酸和B醇生成的一种酯,A酸结构简式为:
,它是由如下的A酸和B醇生成的一种酯,A酸结构简式为:
![]() 则 B醇的分子式为( )
则 B醇的分子式为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
6.已知某溶液中存在![]() ,
,![]() ,
,![]() 和
和![]() 四种离子,其浓度大小有如下关系,其中可能的是( )
四种离子,其浓度大小有如下关系,其中可能的是( )
①![]()
②![]()
③![]() 且
且![]()
④![]()
⑤![]()
A.①④ B.③⑤
C.①②③ D.④⑤
7.在人们的印象中,塑料是常见的绝缘材料,但2000年三名诺贝尔化学奖得主的研究成果表明,塑料经改造后能像金属一样具有导电性,要使塑料聚合物导电,其内部的碳原子之间必须交替地以单键和双键结合(再经掺杂处理).目前导电聚合物已成为物理学家和化学家研究的重要领域.由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是( )
A.![]() B.
B.![]()
C.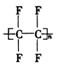 D.
D.![]()
8.白磷易溶于![]() 形成溶液,磷元素在该溶液中存在的形式是( )
形成溶液,磷元素在该溶液中存在的形式是( )
A.![]() 分子 B.磷原子
分子 B.磷原子
C.![]() 分子 D.
分子 D.![]() 或
或![]() 分子
分子
9.下列各溶液中,微粒物质的量浓度关系正确的是( )
A.![]() 溶液中
溶液中
![]()
B.![]() 溶液中:
溶液中:
![]()
C.![]() 溶液中:
溶液中:
![]()
D.![]() 溶液中:
溶液中:
![]()
10.下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
11.下列有关纯铁的描述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
12.若溶液中由水电离产生的![]() ,满足此条件的溶液中一定可以大量共存的离子组是( )
,满足此条件的溶液中一定可以大量共存的离子组是( )
A.![]()
![]()
![]()
![]() B.
B.![]()
![]()
![]()
![]()
C.![]()
![]()
![]()
![]() D.
D.![]()
![]()
![]()
![]()
13.对某酸性溶液(可能含有![]() ,
,![]() ,
,![]() ,
,![]() )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入![]() 溶液,产生的白色沉淀不溶于稀硝酸.
溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
14.能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:![]()
![]()
![]()
B.金属铝溶于盐酸中:![]()
![]()
![]()
C.硫化钠溶于水中:![]()
![]()
![]()
D.碳酸镁溶于硝酸中:![]()
![]()
![]()
15.人们使用四百万只象鼻虫和它们的215磅粪物,历经30多年时间弄清了棉子象鼻虫的四种信息素的组成,它们的结构可表示如下(括号内表示④的结构简式)
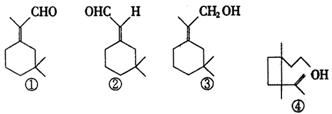

以上四种信息素中互为同分异构体的是:( )
A.①和② B.①和③
C.③和④ D.②和④
6.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗![]() ,故溶液pH减小
,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共18分)
17.(9分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).
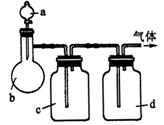
| 气体 | a | b | c | d |
|
| 乙醇 | 浓 |
| 浓 |
|
| 浓盐酸 |
|
| 浓 |
|
| 饱和
| 消石灰 |
| 固体 |
| NO | 稀 | 铜屑 |
|
|
(1)上述方法中可以得到干燥、纯净的气体是____________.
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体____________,理由是____________.
②气体____________,理由是____________.
③气体____________,理由是____________.
④气体____________,理由是____________.
18.(9分)在某浓度的NaOH溶液中滴加几滴酚酞试液,溶液立即呈红色,再向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去.回答下列问题:
(1)产生该现象的原因可能有:
①_________________________________________________________;
②_________________________________________________________.
(2)简述怎样用实验证明红色褪去的原因是①或者是②:_________________________
______________________________________________________.
三、(本题包括两小题,共18分)
19.(8分)有一环保汽车,是以氢气作燃料的,请按题目要求作答:
(1)氢气在发动机内燃烧过程中,生成物只有水蒸气,不会使空气中的________含量偏高,因而能减缓温室效应现的发生.
(2)如果每mol氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式.
20.(10分)科学家通过不断地努力,找到了CO合成甲醇的新方法.CO和![]() 在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇:
在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇:![]()
![]()
![]() .当CO和
.当CO和![]() 的比例不同时,对CO的转化及平衡混合物中甲醇的含量都有影响.以m表示
的比例不同时,对CO的转化及平衡混合物中甲醇的含量都有影响.以m表示![]() 和CO物质的量之比,a为CO的转化率,y为平衡混合物中
和CO物质的量之比,a为CO的转化率,y为平衡混合物中![]() 的体积分数,试推导出m,a,y之间的关系式.
的体积分数,试推导出m,a,y之间的关系式.
四、(本题包括两小题,共20分)
21.(10分)A,B,C,D是四种短周期元素,它们的原子序数依次增大,其中A,C及B,D分别是同一主族元素,B,D元素的原子核中质子数之和是A,C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.
(1)写出四种元素的名称:
A_________;B_________;C_________;D_________;
(2)写出两种均含A,B,C,D四种元素的化合物相互间发生反应,且生成气体的离子方程式____________________________________________________;
(3)写出C和D两元素形成化合物的电子式:_________________________;
(4)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在一极通入A的单质,另一极通入B的单质,写出该电池发生的电极反应式:A极________________________;
B极________________________;
(5)若消耗标准状况下A气体11.2L,该电池能提供的电量为________C.
22.(10分)已知黑色固体X可溶于盐酸,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,C为棕红色,E是金属,如下所示,它们之间有下列变化(其反应条件均略去):
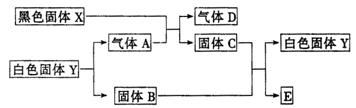
(1)写出化学式:
X__________________________;D__________________________;
(2)写出Y溶于NaOH溶液的离子方程式:______________________________;
(3)写出B与C反应的化学方程式:______________________________.
参考答案
一、
1.D 只有开发使用太阳能可以减少污染源,绿化城市可以减少一些空气污染,但与污染源没有关系.
2.D 利用质量数=核内质子数+核内中子数.
3.D 按照化学计量数反应时,X,Y的转化率相等.
4.A 铜原子数等于铜所占的质量除以铜的摩尔质量.
5.B 根据![]() 可得B为
可得B为![]() .
.
6.C 该溶液是氯化铵溶液,其水解显酸性.
7.B 领会单双键交替的含义.
8.A 易溶于![]() 的物质是非极性分子.
的物质是非极性分子.
9.D 利用原子守恒和电荷守恒是解决这一问题的有效办法.
10.C A中H满足两个电子稳定结构,B中B为6个电子,D中P为10个电子,故答案C正确.
11.D 生铁为合金,熔点低于各成分的熔点,A错误.生铁中含有相当量的碳及其它杂质,当在盐酸中由于构成微小原电池故生成氢气的速率比纯铁的要快,B错误.生铁在潮湿空气中由于构成微小原电池容易被腐蚀,C错误.故D正确.
12.B 由水电离产生的![]() 时溶液成为强酸溶液或强碱溶液,A中
时溶液成为强酸溶液或强碱溶液,A中![]() 、D中
、D中![]() 在碱性条件下不能共存,C中
在碱性条件下不能共存,C中![]() 在强酸中不能共存.故B正确.
在强酸中不能共存.故B正确.
13.B 根据实验①可知含有![]() ,根据实验②确定含有
,根据实验②确定含有![]() ,据实验③可推知有
,据实验③可推知有![]() ,不能确定有无
,不能确定有无![]() ,因
,因![]() 被氯水氧化成
被氯水氧化成![]() .
.
14.A B方程式电荷没配平.C答案中![]() 水解水解应以第一步水解为主,用“
水解水解应以第一步水解为主,用“![]() ”表示.D中方程式中
”表示.D中方程式中![]() 应写分子式.
应写分子式.
15.C ①的分子式为![]() ②的分子式
②的分子式![]() ③的分子式为
③的分子式为![]() ④的分子式为:
④的分子式为:![]() ,根据同分异构体的定义可知③与④为同分异构体.
,根据同分异构体的定义可知③与④为同分异构体.
16.D A中稀![]() 浓度增大,pH应变小.B中电解氢氧化钠溶液,实际电解
浓度增大,pH应变小.B中电解氢氧化钠溶液,实际电解![]() ,故pH增大.由解
,故pH增大.由解![]() 溶液,实际电解水,阴极放出
溶液,实际电解水,阴极放出![]() ,阳极放出
,阳极放出![]() ,物质的量之比为2∶1,故答案D正确.
,物质的量之比为2∶1,故答案D正确.
二、
17.(1)NO (2)①![]() 装置中没有温度计,无法控制反应温度.
装置中没有温度计,无法控制反应温度.
②![]() 反应生成的
反应生成的![]() 被C中的NaOH溶液吸收了.
被C中的NaOH溶液吸收了.
③![]() 反应生成的
反应生成的![]() 被C中的
被C中的![]() 吸收了.
吸收了.
18.(1)①氯水与NaOH反应,![]() 浓度降低而褪色.
浓度降低而褪色.
②氯水中产生HClO漂白酚酞
(2)继续加入NaOH溶液红色再现则证明①正确,反之②正确
三、19.(1)![]() (2)
(2)![]()
![]()
20.设CO为1mol,![]() 为m mol.
为m mol.
![]()
![]()
![]()
起始:1 m 0
平衡:![]()
![]() a
a
则![]()
四、
21.(1)氢 氧 钠 硫 (2)![]()
![]()
![]()
(3)![]() (4)
(4)![]()
![]()
![]()
![]()
![]()
![]()
![]()
(5)96320
22.(1)![]()
![]() (2)
(2)![]()
![]()
![]()
(3)![]()