新教材高考化学模拟试题精编详解(3)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.可能用到的相对原子质量:Ca∶40 0∶16 H∶1
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)
1.最近,美国Lawrece Liermore国家实验室(LINL)的V·Lota·C·S·Yoo和H·cynn成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是( )
的原子晶体说法,正确的是( )
A.![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B.在一定条件下,![]() 原子晶体转化为分子晶体是物理变化
原子晶体转化为分子晶体是物理变化
C.![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D.在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
2.随着世界人口的急剧增长、工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
A.加入明矾,使海水的盐分沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
3.在含有![]() 、
、![]() 、
、![]() 、
、![]() 的稀溶液中,加入足量的
的稀溶液中,加入足量的![]() 固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是( )
固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4.常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,下述结论中正确的是( )
的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则![]()
B.若![]() ,
,![]() ,则混合液中
,则混合液中![]()
C.若混合液的pH=7,则混合液中![]()
D.若![]() ,且混合液的pH<7,则一定有
,且混合液的pH<7,则一定有![]()
5.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下:
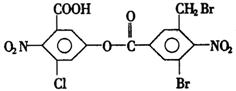
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
A.5mol,10mol B.6mol,2mol
C.8mol,2mol D.8mol,4mol
6.X,Y,Z三种气体,把a
molX和b molY充入一密闭容器中,发生反应:X+2Y![]() 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
7.国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是( )
①对植物的呼吸作用有利
②改良碱性土壤,调节pH
③有利于土壤中![]() ,
,![]() ,被植物吸收
,被植物吸收
④加速光合作用的进行
A.②③④ B.②④ C.② D.①②③④
8.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一.氦的该种同位素应表示为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
9.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有![]() 和
和![]() 的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
A.原子数 B.密度 C.质量 D.质子数
10.某无色混合气体可能由![]() 、
、![]() 、
、![]() 、CO、
、CO、![]() 和HCl中的某几种气体组成.在恒温恒压条件下,将此混合气体通过浓
和HCl中的某几种气体组成.在恒温恒压条件下,将此混合气体通过浓![]() 时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在
时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在![]() 中能够点燃,燃烧产物不能使
中能够点燃,燃烧产物不能使![]() 粉末变色.则 原混合气体的成份是( )
粉末变色.则 原混合气体的成份是( )
A.HCl和CO B.HCl、![]() 和CO
和CO
C.![]() 和
和![]() D.HCl、CO和
D.HCl、CO和![]()
11.将![]() 硝酸铵溶液跟
硝酸铵溶液跟![]() 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.![]()
B.![]()
C.![]()
D.![]()
12.下列反应的离子方程式正确的是( )
A.铝片跟氢氧化钠溶液反应:![]()
![]()
![]()
B.硫酸镁溶液跟氢氧化钡溶液反应:![]()
![]()
![]()
C.碳酸钙跟醋酸反应:
![]()
![]()
![]()
D.铜片跟稀硝酸反应:![]()
![]()
![]()
13.某温度下,在一容积可变的容器中,反应![]()
![]()
![]() 达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍
C.均增加1mol D.均减少1mol
14.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复原来的温度.下列叙述正确的是( )
A.沉淀物的质量为5.6g
B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g
D.饱和石灰水的质量小于98.2g
15.用![]() 溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
16.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17、(10分)![]() 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用![]() ,
,![]() (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取![]() 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.

18.(10分)在冶金工业中,常用焦炭来冶炼铁,其原理是(用化学方程式表示):______________________________.实验室中可用CO还原CuO和![]() ,在加热CuO或
,在加热CuO或![]() 前应________,直到无________现象时才能点燃酒精灯加热,否则可能发生________现象,未反应完全的CO________(填“能”、“不能”)排放到大气中,应________,处理.
前应________,直到无________现象时才能点燃酒精灯加热,否则可能发生________现象,未反应完全的CO________(填“能”、“不能”)排放到大气中,应________,处理.
三、(本题包括三小题,共24分)
19.(8分)利用示踪原子可以研究化学反应.比如乙酸乙酯与水反应,生成醋酸和乙醇,反应方程式为:
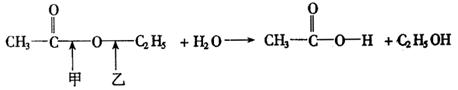
乙酸乙酯 水 醋酸 乙醇
那么,水解过程是从甲处断开还是从乙处断开呢?试分析说明如何通过示踪原子的方法来确定化学反应的过程.
20.(8分)现有化合物甲: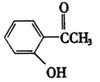 乙:
乙:
丙: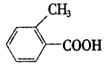
(1)请写出丙中含氧官能团的名称:________,________.
(2)请判别上述哪些化合物互为同分异构体:
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可).
(4)请按酸性由强到弱排列甲、乙、丙的顺序:________、________、________.
21.(8分)2001年诺贝尔化学奖被美国的诺尔斯、沙普雷斯和日本的野依良治获得,以表彰他们发现某些被称为手征性的分子可以用来加速并控制化学反应的创造性工作.在有机物分子中,若某碳原子连接四个不同的原子或基团,则这种碳原子称为“手征性碳原子”.例如: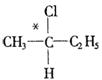 中*C就是“手征性碳原子”.含“手征性碳原子”的物质通常具有不同的光学特征(称为光学活性).
中*C就是“手征性碳原子”.含“手征性碳原子”的物质通常具有不同的光学特征(称为光学活性).
(1)据报道最新合成的有机物A为:![]() 具有光学活性,若要使A失去光学活性,可采用的方法有(最少列举三种方法):
具有光学活性,若要使A失去光学活性,可采用的方法有(最少列举三种方法):
(2)某链烃B的分子式为![]() ,在B的各种结构(不考虑
,在B的各种结构(不考虑![]() 结构)中,含有“手征性碳原子”,且与足量
结构)中,含有“手征性碳原子”,且与足量![]() 加成反应后仍具有光学活性的有机物有五种,已知其中三种的结构简式为:
加成反应后仍具有光学活性的有机物有五种,已知其中三种的结构简式为:
① 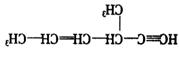
② ![]()
③ 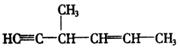
则另两种的结构简式为:
④______________________________________,
⑤______________________________________.
四、(8分)
22.燃料电池是一种新型的无污染、无噪音、高效率的发电设备,是一种很有发展潜力的新能源,它主要由燃料、氧化剂、电极和电解质组成,燃料电池的结构和传统电池一样具有正负电极,正负电极被电解质分隔,它以还原剂(用氢作燃料)为负极反应物,以氧化剂(如空气中的氧气等)为正极交换物,在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
(1)燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:负极______________;正极______________.
(2)氢氧燃料电池可作为载人航天器的首选电池,一个重要原因是它在产生持续电流的过程中生成的产物是水,这正好解决航天员的饮水问题,航天员饮用这些合成水通过消化系统,大部分在被___________吸收.
参考答案
一、
1.D 按原子晶体的特征来思考.
2.A 明矾并不能除去海水中的盐分.
3.C ![]() 与碱反应生成
与碱反应生成![]() .
.
4.A 强酸与弱碱反应,如果恰好完全反应,溶液呈酸性;如果溶液呈中性,则碱溶液过量.
5.C 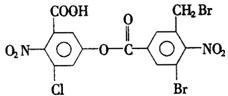 中的酯基与NaOH反应需要2mol
NaOH.
中的酯基与NaOH反应需要2mol
NaOH.
6.B 利用化学方程式进行计算.
7.A 汽水中的成分有二氧化碳.
8.B 在符号![]() 中 Z表示原子的质子数,A表示质量数,故氦的该种同位素应表示为:
中 Z表示原子的质子数,A表示质量数,故氦的该种同位素应表示为:![]() .
.
9.A 同温同压、同体积的气体,所含物质的量相同.HCl与![]() 和
和![]() 的混合气体都为双原子分子,故各自所含原子数也相同.密度与气体的质量有关,质量不同,故密度不同.
的混合气体都为双原子分子,故各自所含原子数也相同.密度与气体的质量有关,质量不同,故密度不同.
质子数也各不相同.
10.A 混合气体通过浓![]() 时总体积不变,则无
时总体积不变,则无![]() 存在;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,则无
存在;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,则无![]() ,一定有HCl存在;把剩余气体导出后,在
,一定有HCl存在;把剩余气体导出后,在![]() 中能够点燃,燃烧产物不能使
中能够点燃,燃烧产物不能使![]() 粉末变色,说明无水生成,则原气体中一定无
粉末变色,说明无水生成,则原气体中一定无![]() ,
,![]() ,能燃烧的气体只能是CO.
,能燃烧的气体只能是CO.
11.B ![]() 的物质的量为:0.02×0.4=0.008(mol),
的物质的量为:0.02×0.4=0.008(mol),![]() 的物质的量为:0.05×0.1=0.005(mol),
的物质的量为:0.05×0.1=0.005(mol),![]() 为0.01mol.
为0.01mol.
首先两溶液混合要考虑下列反应:
![]() ,
,![]() 剩余0.002mol,
剩余0.002mol,
0.008 0.008
由上述分析可得:![]() .
.
12.C A方程式中反应物应有![]() 参加反应,A错误.B中除
参加反应,A错误.B中除![]() 、
、![]() 反应外,还有
反应外,还有![]() 、
、![]() 参加离子反应,B错误.D方程式电荷不守恒,D错误.
参加离子反应,B错误.D方程式电荷不守恒,D错误.
13.C 对于反应2A(气)+B(气)“![]() ”2C(气),容积可变,保持温度和压强不变,平衡时A,B和C的物质的量分别为4mol,2mol和4mol,如果均减半,或均加倍,物质的量变化的倍数与体积变化倍数相同,故浓度不变,平衡不移动,答案A,B错误.均增加1mol相当于在等容积的基础上增大压强,故平衡向右移,C答案正确,则D错误.
”2C(气),容积可变,保持温度和压强不变,平衡时A,B和C的物质的量分别为4mol,2mol和4mol,如果均减半,或均加倍,物质的量变化的倍数与体积变化倍数相同,故浓度不变,平衡不移动,答案A,B错误.均增加1mol相当于在等容积的基础上增大压强,故平衡向右移,C答案正确,则D错误.
14.D 向100g澄清石灰水中加入5.6g生石灰,反应如下:
![]()
5.6g 1.8g 7.4g
生成的7.4g![]() 不能溶解,反应中消耗1.8g水,故与1.8g水对应的原溶质也要析出.故答案D正确.
不能溶解,反应中消耗1.8g水,故与1.8g水对应的原溶质也要析出.故答案D正确.
15.D 酸碱反应的实质是:![]() ,前三者都是pH=3的强酸反应时耗NaOH溶液体积一定相同,
,前三者都是pH=3的强酸反应时耗NaOH溶液体积一定相同,![]() 是弱酸,还有大量没有电离的也要耗NaOH,故耗NaOH体积最大.
是弱酸,还有大量没有电离的也要耗NaOH,故耗NaOH体积最大.
16.C 符合A答案的是氢元素.L层电子为奇数的所有元素即Li、B、N、F所在族的序数与L层电子数相等.L层电子为偶数的所有元素即Be、C、O、Ne,其中Ne为“O”族不符合题意,C答案错误.同样分析,D答案也正确.
二、
17.铁和稀硫酸 氢氧化钠溶液
①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛.
②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A中压强增大,使得反应生成的![]() 溶液进入B,而和NaOH反应,生成
溶液进入B,而和NaOH反应,生成![]() 沉淀.
沉淀.
18.![]()
![]()
![]()
![]() 验纯尖锐爆鸣 爆炸 不能 收集或点燃
验纯尖锐爆鸣 爆炸 不能 收集或点燃
三、
19.如果反应从甲处断开,则乙酸乙酯将与水中的![]() 结合,生成醋酸,醋酸中将含有这里的O.如果从乙处断开,则乙酸乙酯将与水中的
结合,生成醋酸,醋酸中将含有这里的O.如果从乙处断开,则乙酸乙酯将与水中的![]() 结合,生成醋酸,醋酸中将不含有这里的O,而乙醇中则含有这里的O.为此只要采用具有放射性的
结合,生成醋酸,醋酸中将不含有这里的O,而乙醇中则含有这里的O.为此只要采用具有放射性的![]() 做标记的水
做标记的水![]() 来参与化学反应,即可判断.检测生成物的放射性,结果发现生成物中醋酸有放射性,含有
来参与化学反应,即可判断.检测生成物的放射性,结果发现生成物中醋酸有放射性,含有![]() ;而乙醇没有放射性,没有
;而乙醇没有放射性,没有![]() .所以反应一定是从甲处断开的.
.所以反应一定是从甲处断开的.
20.(1)醛基、羟基 (2)甲、乙、丙互为同分异构体.
(3)与三氯化铁溶液作用显色的是甲;与碳酸钠溶液作用有气泡生成的是乙;与银氨溶液共热会发生银镜反应的是丙.
(4)乙>甲>丙
21.(1)①将A与![]() 加成,使—CHO变为
加成,使—CHO变为![]()
②将A氧化,使![]() 变为一CHO
变为一CHO
③将A与![]() 酯化,使
酯化,使![]() 变为
变为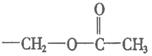
④将A水解,使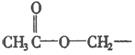 变为
变为![]()
⑤将A与浓![]() 共热,使
共热,使![]() 变为
变为![]()
(2)④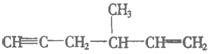
⑤![]()
四、
22.(1)![]()
![]()
![]()
![]()
![]()
![]() (2)小肠
(2)小肠