高考化学试卷(六)
一、选择题:
每小题只有一个选项符合题意。
可能用到的原子量:
H 1 He 4 C12 N 14 O 16 Na 23
Mg24 Al 27 S32 Cl35.5 Zn 65
1. 关于同温同压下等体积的N2O和CO2的叙述:
① 质量相同, ② 碳原子数与氮原子数相等,③ 所含分子数相等,
④ 所含质子总数相等,其中正确的是( )
(A) ①②③ (B) ②③④
(C) ①②④ (D) ①③④
2. a、b、c、d是四种短周期元素,a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,且a的阳离子的氧化性比b的阳离子氧化性弱, c的阴离子所带的负电荷比d的阴离子所带的负电荷多,则它们原子序数大小关系是( )
(A) b>a>d>c (B) a>b>c>d
(C) c>b>a>d (D) b>a>c>d
3. 下列各组物质发生变化时,所克服的微粒间作用力属于同种类型的是( )
(A) 二氧化硅熔化,生石灰熔化
(B) 氯化铵溶解,硝酸溶解
(C) 碘升华,干冰升华
(D) 钠变成蒸气,硫升华成硫蒸气
4. 某金属氧化物的分子式为M2O3,电子总数为50,每个M离子具有10个电子,若其中每
个氧原子核内都有8个中子,M2O3的分子量为102,则M原子核内的中子数为( )
(A) 14 (B) 13
(C) 10 (D) 21
5. 下列叙述正确的是( )
(A) 含有金属阳离子的晶体中一定有阴离子
(B) 共价化合物中可能含有离子键
(C) 离子化合物中可能含有共价键
(D) 非极性分子中一定含有非极性键
6. 碲(Te)是第5周期ⅥA族元素,根据它在周期表中的位置判断,
下列叙述正确的是( )
(A) 碲的单质在通常状况下为固态
(B) H2Te很稳定,不易分解
(C) 存在TeO2和TeO3两种氧化物
(D) H2TeO3是一种较弱的酸
7. 在四个不同的容器中,和不同的条件下进行合成氨反应,根据下列在相同时间内测定的
结果,判断生成氨的速度最快的是( )
(A) VH2=0.3摩/(升·分) (B) VNH3=0.3摩/(升·分)
(C) VN2=0.2摩/(升·分) (D) VH2=0.3摩/(升·分)
8. 反应:2A(气) → xB(气)+2C(气),在一定条件下达到平衡时,密闭容器内的压强增大了
30%,A转化了20%,则此反应中系数x的值为( )
(A) 5 (B) 4
(C) 3 (D) 2
9. 工厂采用下列反应生成甲醇: CO(气)+2H2(气)→ CH3OH(气)+Q 千焦为了增加
产量,提高效率,宜采用的反应条件是( )
(A) 高温、高压、催化剂 (B) 低温、低压、催化剂
(C) 适当的温度、高压、催化剂 (D) 低温、高压、催化剂
|
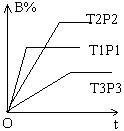
10. 已知某可逆反应: mA(气)+nB(气) → pC(气)+Q千焦 在密闭容器中进行,右图表示在不同反应时间t,温度T和压强p与反应物B在混合气体中的百分含量B%的关系曲线。由图中曲线分析, 下列判断正确的是( ) |
(A) T1<T2, p2>p2, m+n>p, Q>0
(B) T1>T2, p1<p2, m+n>p, Q<0
(C) T1<T2, p1>p2, m+n<p, Q>0
(D) T1>T2, p1<p2, m+n<p, Q<0
11. PH值相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶
液的PH值仍然相同,则m和n的关系是( )
(A) m>n (B) m=n
(C) m<n (D) 不能确定
12. 有四种盐都是由一元酸和一元碱生成的,实验测得盐AX和BY的水溶液PH值都等于7,
AY的水溶液PH值>7,BX的水溶液PH值<7,下列结论正确的是( )
① 盐AX和BY没有发生水解反应,盐AY和BX发生了水解反应
② 酸性HX>HY,碱性AOH>BOH
③ 等物质的量的AY和BX和混合物溶于水,溶液呈中性
④ 等物质的量浓度的HX溶液和HY溶液的pH值前者大于后者
(A) ① ② (B)② ③
(C) ② ④ (D)③ ④
13. 某氨水的PH值为x,某盐酸的PH值为y,已知x+y=14,且x>11,将上述两溶液等体
积混合后,所得溶液中各种离子的浓度由大到小的顺序正确的是( )
(A) [Cl![]() ]>[NH
]>[NH![]() ]>[H
]>[H![]() ]>[OH
]>[OH![]() ]
]
(B) [NH![]() ]>[Cl
]>[Cl![]() ]>[H
]>[H![]() ]>[OH
]>[OH![]() ]
]
(C) [NH![]() ]>[Cl
]>[Cl![]() ]>[OH
]>[OH![]() ]>[H
]>[H![]() ]
]
(D) [Cl![]() ]>[NH
]>[NH![]() ]>[OH
]>[OH![]() ]>[H
]>[H![]() ]
]
14. 等量的苛性钠溶液分别用PH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次
为V![]() 、V
、V![]() ,则两者的关系正确的是(
)
,则两者的关系正确的是(
)
(A) V![]() > 10V
> 10V![]() (B) V
(B) V![]() = 10V
= 10V![]()
(C) V![]() < 10V
< 10V![]() (D) V
(D) V![]() > 10V
> 10V![]()
15. 下列各组中的比值等于2:1的是( )
(A) PH值均为12的纯碱溶液与氢氧化钠溶液的物质的量浓度之比
(B) 硫化钾溶液中[K![]() ]与[S
]与[S![]() ]之比
]之比
(C) 相同温度下,0.2摩/升的醋酸溶液与0.1摩/升醋酸溶液中的[H![]() ]之比
]之比
(D) 10毫升0.5摩/升的盐酸溶液与5毫升0.5摩/升的盐酸溶液中的[H![]() ]之比
]之比
16. 蓄电池在放电时是起原电池的作用,在充电时只起电解池的作用。
下式是爱迪生蓄电池分别在充电和放电时发生的反应:
Fe + NiO2 +
2H2O ![]() Fe(OH)2 + Ni(OH)2
Fe(OH)2 + Ni(OH)2
Fe + NiO2 +
2H2O ![]() Fe(OH)2 + Ni(OH)2
Fe(OH)2 + Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是( )
(A) 放电时Fe是做负极,NiO2是做正极
(B) 充电时阴极上的电极反应式为 Fe(OH)2 + 2e = Fe + 2OH![]()
(C) 放电时电解质溶液中的阴离子是向正极方向移动
(D) 蓄电池的电极必须浸入碱性电解质溶液中
17.用石墨电极电解硝酸银溶液,在阴极收集到0.40克氧气,中和电解时生成的酸需250
毫升氢氧化钠溶液,则氢氧化钠溶液的浓度是( )
(A) 0.20 摩/升 (B) 0.15 摩/升
(C) 0.10 摩/升 (D) 0.05 摩/升
18. 下列物质中,既能跟硫化氢反应,又能跟溴水反应的是( )
① 硫化钠溶液; ② 二氧化硫饱和溶液;
③ 硫酸铜溶液; ④ 硝酸银溶液;
⑤ 氢氧化钠溶液;
(A) ①②③④⑤ (B) ①②③⑤
(C) ①②④⑤ (D) ②④⑤
|
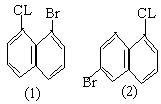
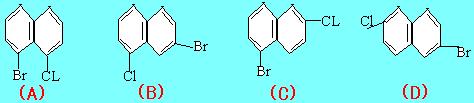
19. 现有下列一些萘衍生物的结构简式,其中与(1)和(2)互为
同分异构体的是( )
|
|
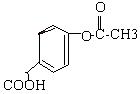
20. 如图,分析此物质的结构,它在一定条件下可能发生的反应有( ) ① 加成; ② 水解; ③ 消去; ④ 酯化; ⑤ 银镜; ⑥ 中和 |
(A) ①②④⑥ (B) ③④⑤⑥
(C) 只有②④ (D) 只有④⑥
21. 有下列各组物质的溶液,常温下用化学方法但不用其它任何试剂就能区别开来的是
( )
(A) AlCl3、CaCl2、Na2SO4、NaHCO3
(B) BaCl2、NaNO3、Na2SO4、Na2CO3
(C) Ca(OH)2、BaCl2、Na2CO3、NaCl
(D) FeCl2、Na2SO4、AlCl3、Ba(OH)2
22. 氧化剂MO(OH)![]() 中的M元素的化合价为+5,25毫升0.028摩/升的Na2SO3 溶液恰好将
中的M元素的化合价为+5,25毫升0.028摩/升的Na2SO3 溶液恰好将
含有2.8×10![]() 摩MO(OH)
摩MO(OH)![]() 的溶液还原并生成SO
的溶液还原并生成SO![]() ,则M元素的最终化合价为( )
,则M元素的最终化合价为( )
(A) +2价 (B) -2价
(C) -1价 (D) 0价
23. 下列离子方程式不正确的是( )
(A) 苯酚钠溶液中加入氯化铝溶液:3C6H5O![]() + Al
+ Al![]() + 3H2O = Al(OH)3↓+ 3Cl6H5OH
+ 3H2O = Al(OH)3↓+ 3Cl6H5OH
(B) 氯化银溶于氨水中:AgCl + 2NH3·H2O = [Ag(NH3)2]![]() Cl
Cl![]() + 2H2O
+ 2H2O
(C) 重铬酸钾溶液和过氧化氢溶液: Cr2O![]() + 2H2O2 + 14H
+ 2H2O2 + 14H![]() = 2Cr
= 2Cr![]() + O2↑+ 9H2O
+ O2↑+ 9H2O
(D) 漂白粉溶液中通SO2气体: Ca![]() + 2ClO
+ 2ClO![]() + SO2 + H2O = CaSO4↓ + 2Cl2↑
+ SO2 + H2O = CaSO4↓ + 2Cl2↑
24. 关于a克H2 与b克He的下列说法正确的是( )
(A) 同温同压下,H2 与He的体积比为a:2b
(B) 同温同压下,若a=b,则H2 与 He的物质的量比为1:1
(C) 体积相同时,He的质量一定大于H2
(D) 同温同压下,若二者的物质的量相等,其体积也相等
25. 在一密闭容器中盛m升Cl2和H2的混和气体,用电火花引燃后,恢复到原状态,发现混合气体仍为m升,用足量的NaOH溶液吸收引燃后的气体,结果气体被完全吸收。由以上可知,原混和气体中,Cl2和H2的物质的量之比是( )
(A) Cl2 : H2 ≥1 (B) Cl2 : H2 <1
(C) Cl2 : H2 >1 (D) Cl2 : H2 ≤1
26. 某种混和气体,可能含有N2、HCl、CO,把混和气体依次通过足量的饱和NaHCO3溶液和灼热的CuO粉末,气体的体积都没有变化;再继续通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜网,经充分反应的气体体积又减小,以至还有部分气体剩余。以下对原混和气体的判断中,正确的是( )
(A) 一定没有N2,在CO和HCl中至少有一种
(B) 一定有N2、HCl和CO
(C) 一定有N2,在CO和HCl中至少有一种
(D) 一定有N2和HCl,没有CO
二、分析和实验题:
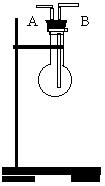
|
1.利用右图所示装置收集以下8种气体(烧瓶的位置不得移动) ① H2 ② CL2 ③ CH4 ④ NH4 ⑤ NH3 ⑥ NO ⑦ H2S ⑧ SO2 |
(1) 若烧瓶是干燥的,则由A口进气可收集的气体有( )
(A) ③、④、⑥、⑧ (B)②、④、⑦、⑧
(C) ①、③、⑥ (D)①、②、④、⑤、⑧
(2) 若烧瓶是充满水的,可收集的气体有( )
(A) ③、④、⑥、⑧ (B)②、④、⑦、⑧
(C) ①、③、⑥ (D)①、②、④、⑤、⑧
(3) 若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置的气体有( )
(A) ③、④、⑥、⑧ (B)②、④、⑦、⑧
(C) ①、③、⑥ (D)①、②、③、④
(4) 若烧瓶是干燥的,不能用此装置来收集的气体有( )
(A) ⑥、⑧ (B)②、⑧
(C) ⑥ (D)①
2.实验室里需要纯净的氯化钠溶液,但现只有一瓶混有少量硫酸钠和碳酸氢钠的氯化钠固
体。实验方案如下:
(1) 操作①可选择( 坩埚 )或(大试管)仪器。
请判断:( )
(2) 操作②为什么不用硝酸钡溶液,其理由是什么?
[答]:
(3) 进行操作②后,如何判断SO![]() 已除尽,方法是什么?
已除尽,方法是什么?
[答]:
(4) 操作③目的是什么?为什么不先过滤后加碳酸钠溶液?
[答]:
三、
1. 有A、B、C、D、E5种化合物,其中A、B、C、D均是含一种常见金属元素的化合
物;F是一种气体,标准状态下的密度是空气密度的1.103倍。
上述6种物质的反应关系是:
① A + NaOH → D + H2O ② B →(加热)A + H2O
③ C + NaOH(适量) → B↓ + NaCl ④ E + H2O → NaOH + F↑
⑤ C + D + H2O → B↓
(1) 经分析、推断,上述6种物质A,B,...,F分子式?
[答]:
(2) 写出4摩尔C和6摩尔E在水溶液中发生反应的方程式?
[答]:
2. A、B、C是中学化学中常见的三种化合物,它们各由两种物质元素组成,甲、乙是两
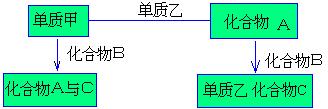 |
种单质。这些化合物和单质之间存在如下关系:
据此推断:
(1) 在A、B、C这三种化合物中,必定含有乙元素的是( )
(A)A (B)A、B
(C)A、C (D)B、C
(2) 单质乙必定是什么?其理由是什么?
[答]:
(3) 单质乙的分子式可能是(S或N2),则化合物B的分子式是( H2S 或NH3).
( )
3.常温下呈气态的饱和烃X与不饱和烃的混和气体对氢气的相对密度为28.5,
已知X与Y中含碳原子数相同。
(1) 求X、Y的分子式。 求X与Y的体积比。
[答]:
(2) 若在150 度和1.01×10![]() 帕下,将1升该混和气体与8升氧气混和,充入密闭容器中
帕下,将1升该混和气体与8升氧气混和,充入密闭容器中
充分燃烧后恢复原来状态,问此时混和气体的总体积?
[答]:
参 考 答 案
一、
1. D 2. A 3. C 4. A 5. C 6. B 7. C 8. C
9. C 10. B 11. A 12. B 13. A 14. D 15. A 16. C
17.A 18. C 19. B 20. A 21. D 22. D 23. D 24. D
25. A 26. B
二、
1. (1) B (2) C (3) D (4) C
2.
(1) 对
(2) [答]:因为加Ba(OH)2 溶液,可产生BaSO4沉淀,但会使溶液引入NO![]() 杂质离子。
杂质离子。
(3) [答]:取上层清液,加少量Na2SO4 溶液,如无沉淀产生,说明SO![]() 离子已经除净。
离子已经除净。
(4) [答]:目的是使HCL 逸出,减少氯化钠的损失。
三、1.
(1) [答]:A:AL2O3、 B:AL(OH)3 、 C:ALCL3、
D:NaALO2、 E:Na2O2、 F:O2
(2) [答]: 4ALCL3 + 6Na2O2 + 2H2O = 4AL(OH)3↓ + 12NaCL
2. (1) B
(2) [答]:非金属, 化合物A、B反应能生成单质乙,说明A、B中含有乙元素
化合价分别为正价和负价,而金属没有负价。
(3) 对
3.(1) [答]:X与Y的混和气体的平均分子量为 28.5×2=57,则![]() ,
,
即 X与Y分子式分别为:x为C4H10,y为C4Hm。若混和气中C4Hm含有x,
则含有C4H10 为(1-x),有:(48+m)x+58×(1-x)=57,整理得1—x(10—m)=0
因为Y为不饱和烃,且分子中碳原子数为4,则m应大于4,可能为6或8,
当m=6时,代入方程式,得出 x=0.25.
当m=8时,代入方程式,得出 x=0.5.
即混和气体为C4H10和C4H6时,它们的体积比为3:1。
当混和气体为C4H10和C4H8时,它们的体积比为1:1。
(2)[答]:
又设混和气体平均分子量为C4Hn,根据C4Hn=57,求出 n=9,即平均分子式为C4H9.
2C4H9
+ ![]() = 8 CO2
+ 9H2O
= 8 CO2
+ 9H2O
2 12.5 8 9
1 x y z
解出:x=6.25升,y=4升,z=4.5升。
则生成混和气体的体积为:6.25升+4升+4.5升=10.25升.