选择题强化训练(18)
一、选择题(每小题4分,8小题共32分,每小题只有一个正确选项)
1、下列物质中,可用于治疗胃酸过多的是
A 、碳酸钠 B、氢氧化钠 C、氧化钠 D、碳酸钡
2、钛(Ti)金属常被称为未来钢铁。钛元素的同位素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中,中子数不可能为
中,中子数不可能为
A、30 B、28 C、26 D、24
3、0.05mol某单质与0.8g硫在一定条件下完全反应,该单质可能是
A、H2 B、 O2 C、K D、Zn
4、下列反应中,调节反应物用量或浓度不会改变反应产物的是
A、硫化氢在氧气中燃烧 B、铁在硫蒸气中燃烧
C、二氧化硫通入石灰水 D、硫酸中加入锌粉
![]() 5、二氧化氮存在下列平衡:2NO2(g) N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
5、二氧化氮存在下列平衡:2NO2(g) N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
A、温度130℃、压强3.03×105Pa B、温度25℃、压强1.01×105Pa
C、温度130℃、压强5.05×104Pa D、温度0℃、压强5.05×104Pa
6、下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用洒精中
A、②③①④ B、③②①④ C、③①②④ D、①②③④
7、在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A、小于100mL B、等于100mL C、大于100mL D、等于100/ρmL
8、在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为
A、1.34mL B、2.240mL C、0.672mL D、0mL
二、选择题(本题共40分每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分)
9、冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3→ClO+O2 ,ClO+O→Cl+O2下列说法不正确的是
A、反应后将O3转变为O2 B、Cl原子是总反应的催化剂
C、 氟氯甲烷是总反应的催化剂 D、Cl原子反复起分解O3的作用
10、下列各组离子在水溶液中能大量共存的是
A、H+ 、Fe2+ 、NO3- 、Cl- B、S- 、Na+ 、OH- 、K+
C、K+ 、CO32-、Br- 、AlO2- D、H+ 、Cl- 、Na+ 、S2O32-
11、同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3 ②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A、①>② B、①<② C、①=② D、不能确定
12、甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
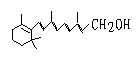 A、5.4g B、3.6g C、2.7g D、1.6g
A、5.4g B、3.6g C、2.7g D、1.6g
13、己知维生素A的结构简式可写为
式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是
A、维生素A的分子式为C20H30O B、维生素A 是一种易溶于水的醇
C、维生素A分子中有异戊二烯的碳链结构
D、1mol维生素A 在催化剂作用下最多可与7molH2发生加成反应
14、下列离子方程式书写正确的是
A、过量氯气通入溴化亚铁溶液中 3Cl2 + 2Fe2 + + 4Br- = 6Cl-+2Fe3++2Br2
B、过量二氧化碳通入偏铝酸钠溶液中 CO2+2H2O+AlO2- = Al(OH)3↓+HCO3-
C、亚硫酸氢铵溶液与等物质的量氢氧化钠混合 NH4+ +HSO3- +2OH- = SO32-+NH3↑+2H2O
D、碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+MgCO3↓
15、![]() 已知酸性强弱顺序为H2CO3> >HCO
已知酸性强弱顺序为H2CO3> >HCO![]() ,下列化学方程式正确的是BC
,下列化学方程式正确的是BC
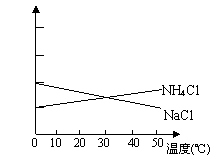
16、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl.NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
| 通入气体 | 温度控制 | |
| (A) (B) (C) (D) | CO2 CO2 NH3 NH3 | 30~40℃ 0~10 ℃ 30~40 ℃ 0~10℃ |
![]()
![]()
17、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为
A、Mg B、Ca C、Sr D、Ba
![]() 18、对于平衡体系mA(g) +
nB(g) pC(g) + qD(g) ;⊿H<0。 有下列判断,其中正确的是
18、对于平衡体系mA(g) +
nB(g) pC(g) + qD(g) ;⊿H<0。 有下列判断,其中正确的是
A、若温度不变,将容器的体积增大为原来的两倍,此时A物质的浓度
变为原来的0.48倍,则m + n <p + q
B、若平衡时A、B的转化率相等,说明反应开始时A、B的物的量之比为n: m ;
C、若温度不变而压强增大为原来的两倍,则达到新的平衡时平衡混合物的体积小于原体积的1/2
D、若平衡体系共有a mol气体,再向其中加入b molB,当达到
新平衡时共有(a + b)mol气体,则m + n = p + q
![]() 19、以下现象与电化腐蚀无关的是
19、以下现象与电化腐蚀无关的是
A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 B、生铁比软铁芯(几乎是纯铁)容易生锈
C、铁质器件附有铜质配件,在接触处易生铁锈 D、银质奖牌久置后表面变暗