选择题强化训练(10)
一、选择题(每小题只有一个正确答案,每小题4分,8小题共32分)
1、生活中碰到某些问题,常常涉及到化学知识,下列分析不正确的是
A、白色污染通常是指聚乙烯等塑料垃圾; B、食盐加碘,其中的碘以单质形式存在;
C、用工业酒精兑的酒中含甲醇可至人失明甚至死亡;
D、造成大气污染的SO2、CO和NO,主要来源于煤的燃烧和汽车排放的尾气。
2、为了除去镀在铝表面的铜镀层,可选用的试剂为
A、浓硫酸 B、稀硝酸 C、 浓烧碱溶液 D、浓硝酸
3、新近研制的溴—锌蓄电池的基本结构是用碳棒作两极,用ZnBr2溶液作电解液,现有四个电极反应:①Zn – 2e = Zn2+ ②Zn2+ + 2e = Zn ③Br2 + 2e = 2Br- ④2Br- - 2e = Br2 ,充电时的阳极和放电时的负极反应分别依次为
A、④① B、②③ C、③① D、②④
4、下列每组各有三对物质,它们都能用分液漏斗分离的是
A、乙酸乙酯和水,酒精和水,苯酚和水 B、二溴乙烷和水,溴苯和水,硝基苯和苯
C、甘油和水,乙醛和水,乙酸和乙醇; D、油酸和水,甲苯和水,已烷和水。
5、有关氯化铁溶液与氢氧化铁胶体的性质的叙述中错误的是( )
A、FeCl3溶液稳定,而Fe(OH)3胶体则不稳定; B、加入烧碱溶液均有沉淀析出;
C、加热蒸干,灼烧后均有氧化铁生成; D、都能透过滤纸。
6、在室温下将pH=3的硫酸溶液与pH=12的烧碱溶液混合溶液后溶液pH=11,则硫酸与烧碱溶液的体积之比是
A、9:2 B、2:9 C、9:4 D、9:1
7、硫代硫酸钠可作为脱氧剂,已知25.0mL0.1mol/LNa2S2O3溶液恰好把224mL(标况)Cl2完全转化成Cl-,则S2O32-将转化成
A、S2- B、S C、SO32- D、SO42-
8、已知常温下有pH=2的某一元弱酸HA溶液,又知0.01mol/L的一元碱BOH溶液中[OH-]/[H+]=1010,将上述两溶液等体积混合,所得溶液中离子浓度大小关系正确的是
A、[OH-]>[H+]>[B+]>[A-] B、[B+]>[A-]>[OH-]> [H+]
C、[A-]>[B+]>[H+]>[OH-] D、[B+]=[A-]>[H+]=[OH-]
二、选择题(每小题有1~2个正确答案,每小题4分,10小题共40分)
9、下列各组气体中,两种气体的分子数一定相等的是
A、压强相同,体积相同的CO和H2; B、同温同压下,1LH2和1LCO、O2的混合气;
C、质量相等、密度不等的N2和C2H4; D、体积相等,密度不等的N2和CO;
![]() 10、赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O
+ Cu2S
6Cu + SO2 ; 对于该反应,下列说法中错误的是
10、赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O
+ Cu2S
6Cu + SO2 ; 对于该反应,下列说法中错误的是
A、反应中铜元素既被氧化又被还原; B、还原产物与氧化产物的物质的量之比为6:1;
C、Cu2O在反应中只作氧化剂; D、反应中被氧化的元素是S
11、通常把原子数和电子数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中错误的是
A、B3N3H6分子各原子均在同一平面上; B、B3N3H6分子中不存在双键;
C、H3O+和NH4+是等电子体;均为三角锥形 D、CH4和NH4+是等电子体,均为正四面体结构
12、下列说法中正确的是
A、核外电子排布完全相同的两种微粒,其化学性质一定相同;
B、难失电子的原子,一定具有强氧化性;
C、一种离子和一种分子的质子数和电子数不可能同时相等。
D、共价化合物溶于水电离过程中,共价键被破坏。
13、用NA表示阿佛加德罗常数,下列说法不正确的是
A、常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA;
B、醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等;
C、标况下,22.4L氨气所含电子数为7NA;
D、a g某气体含分子数为b,c g该气体在标况下的体积为22.4bc/(aNA)升。
14、下列反应的离子程式正确的是
A、硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
B、氯化铝溶液通入过量氨气:Al3+ + 4OH- = AlO2- + 2H2O
C、大理石溶于醋酸:CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + H2O + CO2↑
D、次氯酸钙溶液中通入过量CO2:Ca2+ + 2ClO- + H2O + CO2 = CaCO3↓+ 2HClO
15、用向下排气法在容积为VmL的集气瓶中收集氨气。由于空气未排尽,最后瓶内气体的平均相对分子质量为19。将此盛满气体的集气瓶倒置于水中,瓶内水面上升到一定高度后即停止上升。则在同温同压下,瓶内剩余气体的体积(mL)为
A、V/4 B、V/5 C、V/6 D、0
16、在某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的气体在标况下的体积为
A、36L B、28L C、22.4L D、11.2L
17、A、B两个烧杯中分别盛有100mL3.0mol/LHCl和NaOH溶液,向两个烧杯中分别加入等质量的Al粉,在相同条件下产生气体的体积比为A:B=2:5,则加入Al粉的质量为
A、8.1g B、6.75g C、5.4g D、2.7g
18、锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为Zn(s) + 2MnO2 + 2NH4+ = Zn2+ + Mn2O3 + 2NH3 + H2O,电极放电时,正极表面发生的反应的物质是
A、Zn B、石墨 C、MnO2 D、NH4+
![]() 19、设NA为阿佛加德罗常数,下列叙述中正确的是( )
19、设NA为阿佛加德罗常数,下列叙述中正确的是( )
A、在标况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA;
B、常温常压下,30克乙酸与30克葡萄糖含有的氧原子数都是NA;
C、1mol-OH所含的电子数为17NA;
D、1L1mol/L的硫酸铵溶液中铵根离子数会小于2NA;
20、下列离子方程式中正确的是( )
A、向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全
Ba2+ + 2OH- + NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
B、碳酸氢钠的水解:HCO3- + H2O = H3+O + CO32-
C、硫酸铝加过量氨水:Al3+ + 4OH- = AlO2- + 2H2O
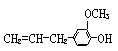 D、漂白粉溶液中通入少量的SO2: Ca2+ +
2ClO- + SO2 + H2O = CaSO3↓+
2HClO
D、漂白粉溶液中通入少量的SO2: Ca2+ +
2ClO- + SO2 + H2O = CaSO3↓+
2HClO
21、有机物丁香油酚的结构简式为: ,其可能具有的性质是:①能发生加成反应;②能使酸性高锰酸钾溶液褪色;③能发生显色反应;④能发生取代反应;⑤能发生中和反应;⑥能发生消去反应。
A、全部 B、仅能发生①②③④ C、除⑥外都能 D、除④⑥外都能