高考热点专题测试卷:专题八 信息迁移题
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.据报道,科学家用激光将置于铁室中石墨靶上的碳炸松,与此同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜.这种化合物比金刚石更坚硬,其原因可能是( )
A.该化合物为离子晶体 B.碳氮键比金刚石中碳碳键更短
C.碳氮的单质化学性质均不活泼 D.氮原子最外层电子数比碳原子多
2.一种新型的灭火剂叫“1211”,其分子式是![]() .命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的“0”可略去).按此原则,对下列几种新型灭火剂的命名不正确的是( )
.命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的“0”可略去).按此原则,对下列几种新型灭火剂的命名不正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
3.现在盐酸、硝酸、氢氧化钠、氢氧化钾的稀溶液,当酸跟碱混合,生成1
mol水时都放出57.27kJ的热量,则对下列反应:![]() 可以判断Q的数值:( )
可以判断Q的数值:( )
A.等于57.27 kJ B.大于57.27 kJ
C.小于57.27 kJ D.无法判断
4.已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是![]() 据此判断醋酸铅是( )
据此判断醋酸铅是( )
A.易溶强电解质 B.易溶弱电解质
C.难溶强电解质 D.难溶弱电解质
5.已知1 mol白磷变成1 mol红磷放出18.39 KJ的热量,下面两个反应:
![]()
![]()
由此可以断定( )
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.汽车尾气(含有烃类,CO、NO和![]() 等)是城市空气的主要污染源.治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及
等)是城市空气的主要污染源.治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及![]() 的转化.下列说法中错误的是( )
的转化.下列说法中错误的是( )
A.CO和NO反应的化学方程式为![]()
B.此方法的缺点是由于![]() 的增多,会大大提高空气的酸度
的增多,会大大提高空气的酸度
C.汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染
D.增大绿化面积,多植树造林,可有效控制城市空气污染源
7.卤代反应的难易程度与烃分子中氢的类型有关.伯(![]() ),仲(
),仲(![]() ),叔(
),叔(![]() )三种氢原子活性之比为1∶3.8∶5.如果控制条件使丙烷发生一氯代反应后,则所得产物
)三种氢原子活性之比为1∶3.8∶5.如果控制条件使丙烷发生一氯代反应后,则所得产物![]() 占全部一氯化物分子总数的( )
占全部一氯化物分子总数的( )
A.45% B.28% C.64% D.36%
8.氮化铝(AlN)是一种熔点很高,硬度大,不导电,难溶于水和其他溶剂的晶体,将下列各组物质加热熔化或气化,所克服微粒间作用力与AlN克服微粒间的作用力都相同的是( )
A.水晶、金刚石 B.食盐、硫酸钾
C.碘、硫 D.石墨、硅
9.有一种![]() 型分子,在该分子中以A为中心原子,下列有关它的分子构型和有关同分异构体的各种说法正确的是( )
型分子,在该分子中以A为中心原子,下列有关它的分子构型和有关同分异构体的各种说法正确的是( )
A.假若为平面四边形,则有2种同分异构体
B.假若为四面体,则有2种同分异构体
C.假若为平面四边形,则无同分异构体
D.假若为四面体,则无同分异构体
10.自然科学史中很多发现和发明都是通过类比推理法提出来的.现在化合物A的结构简式是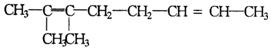 它与过量的酸性高锰酸钾溶液作用得到下列三种化合物:
它与过量的酸性高锰酸钾溶液作用得到下列三种化合物: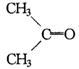 ,
,![]() ,
,![]() .若化合物B与A互为同分异构体,且A、B分别与酸性高锰酸钾溶液反应得到的产物相同,则化合物B的结构简式正确的是( )
.若化合物B与A互为同分异构体,且A、B分别与酸性高锰酸钾溶液反应得到的产物相同,则化合物B的结构简式正确的是( )
A.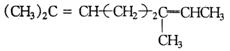
B.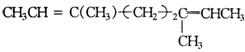
C.![]()
D.![]()
11.已知HBrO比![]() 酸性弱,
酸性弱,![]() 比HBrO难电离,则下列反应不能发生的是( )
比HBrO难电离,则下列反应不能发生的是( )
A.![]()
B.![]()
C.![]()
D.![]()
12.在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需![]() .的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热
.的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热![]() ,以上事实表明( )
,以上事实表明( )
A.1,3环己二烯加氢是吸热反应 B.1,3-环己二烯比苯稳定
C.苯加氢生成环己烷是放热反应 D.苯比1,3-环己二烯稳定
13.与醛基相邻的碳原子上的氢原子叫a—H,无a—H的醛在强碱作用下,发生分子间氧化——还原反应生成酸和醇,叫做康尼查罗反应,例如![]()
![]() ,则下列化合物中不发生康尼查罗反应的是( )
,则下列化合物中不发生康尼查罗反应的是( )
①![]() ②
②![]() ③
③![]() ④
④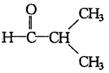
A.①② B.①②④ C.③④ D.①②③④
三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.
14.化学上鉴定![]() 的方法之一,是使用
的方法之一,是使用![]() 溶液作试剂.将
溶液作试剂.将![]() 溶液逐渐滴入含有
溶液逐渐滴入含有![]() 的溶液中时,会有以下反应发生:
的溶液中时,会有以下反应发生:
![]()
![]()
![]()
对于鉴定![]() 的下列叙述不正确的是( )
的下列叙述不正确的是( )
A.该鉴定可在酸性或碱性溶液进行
B.该鉴定只能在中性溶液中进行
C.![]() 必须过量
必须过量
D.![]() 对该鉴定有干扰
对该鉴定有干扰
15.已知烯烃 能被
能被![]() 氧化,其反应可表示为
氧化,其反应可表示为
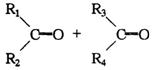 ;苯分子中单、双键可以互变,且苯也能被
;苯分子中单、双键可以互变,且苯也能被![]() 氧化.某苯的同系物分子式
氧化.某苯的同系物分子式![]() ,若将
,若将![]() 被
被![]() 氧化后,可生成3 mol
氧化后,可生成3 mol ![]() ;2 mol
;2 mol ![]() ;1 mol
;1 mol ![]() ,则
,则![]() 的结构式为( )
的结构式为( )
A.![]() B.
B.
C. D.
D.![]()
16.对于一般的可逆反应,mA+nB![]() pC+qD,在一定温度下达到平衡时,反应物及生成物浓度满足下面关系:
pC+qD,在一定温度下达到平衡时,反应物及生成物浓度满足下面关系:![]() ,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:
,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:![]()
![]()
![]() ;且K=1,若用2 mol CO和
;且K=1,若用2 mol CO和![]() (气)相互混合并加热到800℃,则CO的转化率为( )
(气)相互混合并加热到800℃,则CO的转化率为( )
A.16.7% B.50% C.66.7% D.83%
17.重铬酸铵![]() 是一种受热易分解的盐,下列各组对重铬酸铵受热分解产物的判断,符合实际的是( )
是一种受热易分解的盐,下列各组对重铬酸铵受热分解产物的判断,符合实际的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
18.烯烃与CO、![]() 在催化剂作用下生成醛的反应叫烯烃的醛化反应.乙烯的醛化反应为:
在催化剂作用下生成醛的反应叫烯烃的醛化反应.乙烯的醛化反应为:![]() 由
由![]() 的烯烃进行醛化反应,得到醛的各同分异构体的数目应为( )
的烯烃进行醛化反应,得到醛的各同分异构体的数目应为( )
A.2种 B.3种 C.4种 D.5种
19.![]() 是离子化合物,它和水作用可产生
是离子化合物,它和水作用可产生![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 和
和![]() 的电子层结构都与氖原子相同
的电子层结构都与氖原子相同
B.![]() 的半径大于
的半径大于![]() 的半径
的半径
C.![]() 与盐酸反应可生成两种盐
与盐酸反应可生成两种盐
D.![]() 和水反应时,
和水反应时,![]() 是还原剂
是还原剂
20.人体血液的pH为7.35~7.45,其中含有一对物质能抵外来少量酸和碱而保持pH基本稳定,这对物质可能是( )
A.NaCl—HCl B.![]()
C.NaOH—HCl D.![]()
21.环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息,这些污染物是( )
A.二氧化硫、氮氧化物、一氧化碳、悬浮微粒
B.二氧化硫、氮氧化物、二氧化碳、悬浮微粒
C.稀有气体、氮氧化物、一氧化碳、悬浮微粒
D.稀有气体、氮氢化物、一氧化碳、悬浮微粒
22.质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号).峰的强度与结构中的H原子数成正比.例如乙酸分子的PMR谱中有两个信号峰,其强度比为3∶1.现有某化学式为![]() 的有机物的PMR谱有三个峰,其强度比为3∶2∶1,则该有机物的结构简式不可能是( )
的有机物的PMR谱有三个峰,其强度比为3∶2∶1,则该有机物的结构简式不可能是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 分值 | 3分 | 3分 | 3分 | 3分 | 3分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 分值 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 |
第Ⅱ卷(共67分)
四、本题包括2小题,共16分
23.(8分)已知向![]() 离子溶液中滴加氨水,生成
离子溶液中滴加氨水,生成![]() 白色沉淀;但是氨水过量时,沉淀又溶解,生成了
白色沉淀;但是氨水过量时,沉淀又溶解,生成了![]() .此外,
.此外,![]() 既可溶于盐酸,也可溶于过量NaOH溶液中,生成
既可溶于盐酸,也可溶于过量NaOH溶液中,生成![]() ,所以
,所以![]() 是一种两性氢氧化物.现有4组离子,每组有2种金属离子.请各选用1种试剂,将它们两者分开.可供选用的试剂有:
是一种两性氢氧化物.现有4组离子,每组有2种金属离子.请各选用1种试剂,将它们两者分开.可供选用的试剂有:
A.硫酸 B.盐酸 C.硝酸
D.氢氧化钠溶液 E.氨水(填写时用字母代号)
请填写下表
| 离子组 | 选用的试剂 (代号) | 沉淀物的 化学式 | 保留在溶液 的离子 |
| (1) | |||
| (2) | |||
| (3) | |||
| (4) |
24.(8分)工业上产生的硫化氢要经过处理变成硫单质后方能排放,以防止大气污染.富玛克斯法治理硫化氢的方法和步骤如下:
①用2%~3%的![]() 溶液做吸收剂生成2种酸式盐;
溶液做吸收剂生成2种酸式盐;
②再加入一种RNO(液)(R表示芳香烃基)与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH与空气中的氧发生反应又得到RNO.写出上述四步反应的化学方程式:
①________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________.
五、本题包括2小题,共18分
25.(8分)醛类(R—CHO)分子中的羰基是强的吸电子基,从而表现以下两方面的性质:
①羧基接受带负电荷或部分负电荷的原子或原子团进攻,发生加成反应,称为“亲核加成”;
②a—氢(![]() )表现出一定的酸性,能与碱作用产生碳负离子;
)表现出一定的酸性,能与碱作用产生碳负离子;![]() .
.
(1)醛与亚硫酸氢钠加成反应的过程如下:
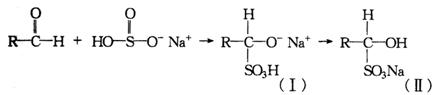
为什么(I)会转化成(Ⅱ)?答:_________________________________.
(2)已知![]()
则A的结构简式为_________________________________.
(3)试写出乙醛与![]() 作用产生的碳负离子的电子式_________________,该碳负离子又可以进攻另一个乙醛分子,发生加成反应:
作用产生的碳负离子的电子式_________________,该碳负离子又可以进攻另一个乙醛分子,发生加成反应:![]()
则C、D的结构简式分别为_________________________________.
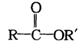
26.(10分)已知:R表示烃基,![]() 表示烃基或氢原子,X表示卤原子
表示烃基或氢原子,X表示卤原子
① ,
,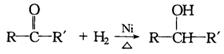 ,
,
②![]()
链烃A能发生如下图所示的一系列变化
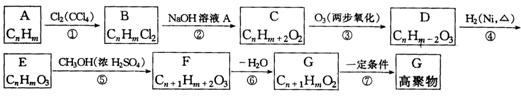
在上述转化中,已知2个E分子间可脱去水分子缩合生成环状化合物![]() .试填写下列空白:
.试填写下列空白:
(1)![]() 的结构简式为________________.
的结构简式为________________.
(2)链烃A的结构简式为________________________.
(3)在反应①~⑦中属于取代反应的是________________.
(4)写出反应④、⑦的化学方程式:
④________________________________________________________________________,
⑦________________________________________________________________________.
六、本题包括2小题,共17分
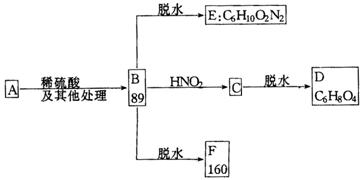
27.(10分)已知a—氨基酸能与亚硝酸反应得到a—羟基酸,例如:
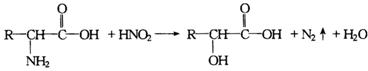
现有某a—氨基酸盐A,其分子中原子数之比为C∶H∶O∶N=3∶10∶2∶2,由它开始有如下图所示的反应关系,其中无机产物均已略去,括号中的数字为其相对分子质量:
(1)写出下列有机物的结构简式:D._______________、E._______________、F._______________.
(2)写出下列转化的化学方程式:
①B→C___________________________________________________________________,
②A→B___________________________________________________________________.
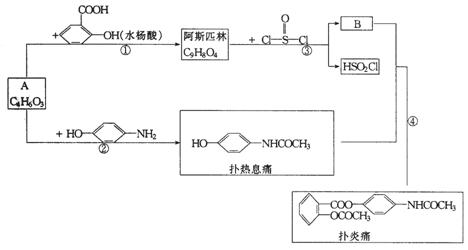
28.(7分)扑炎痛(又名贝诺酯)是一种新型的解热镇痛消炎药物.其合成路线可用下面的图示表示(除主要产物外,其余生成物均略去),请分析回答:
(1)A和B的结构简式:A______________;B______________.
(2)图示中各步反应属于取代反应的有(填编号)_______________.
七、本题包括2小题,共16分.
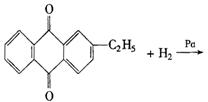
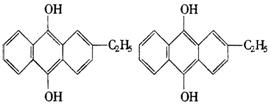
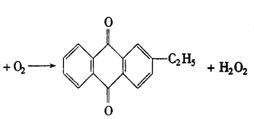
29.(6分)工业上可用乙基蒽醌(下面图解中A)制备![]() ,其工艺流程简单表示如下:
,其工艺流程简单表示如下:
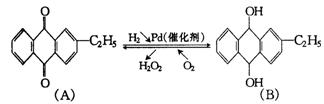
试回答:
(1)上述反应中涉及氧化反应的方程式可写成_____________;涉及还原反应的方程式可写成_____________.
(2)“绿色化学”是当今社会人们提出的一个新概念.在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:
![]()
如:![]()
则制备![]() 工艺的原子利用率为
工艺的原子利用率为![]() .因此,在绿色化学工程中,理想状态原子利用率为100%.试问本题提供的生产
.因此,在绿色化学工程中,理想状态原子利用率为100%.试问本题提供的生产![]() 方法,可否称为理想状态的“绿色工艺”?简述理由.
方法,可否称为理想状态的“绿色工艺”?简述理由.
30.(10分)用![]() 和硫粉在水溶液中加热反应,可制得
和硫粉在水溶液中加热反应,可制得![]() ,10℃和70℃时,
,10℃和70℃时,![]() 的溶解度分别为60.0 g和212 g.常温下从溶液中析出的晶体是
的溶解度分别为60.0 g和212 g.常温下从溶液中析出的晶体是![]()
![]() ,
,![]() 在酸中完全分解:
在酸中完全分解:![]() ;现取
;现取![]() 溶于80.0 mL水.另以5.00 g硫粉,用少许乙醇润湿后(以便硫被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发,浓缩、冷却至10℃后析出
溶于80.0 mL水.另以5.00 g硫粉,用少许乙醇润湿后(以便硫被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发,浓缩、冷却至10℃后析出![]()
![]() 晶体.
晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是________(填写选项的字母)
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH D.会减少产量
(2)反应1小时后过滤,其目的是________________________.
(3)滤液中除![]() 和可能未反应完全的
和可能未反应完全的![]() 外,最可能存在的无机杂质是_________.
外,最可能存在的无机杂质是_________.
(4)设![]() 跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约为30.0mL,该溶液是否达到饱和?试通过计算说明.(70℃时,
跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约为30.0mL,该溶液是否达到饱和?试通过计算说明.(70℃时,![]() 饱和溶液密度为
饱和溶液密度为![]() )
)
(5)若要计算在100℃时将溶液蒸发至体积为30.0 mL,再冷却至10℃时所能得到的![]() 的质量,你认为________.(填入一个选项的字母)
的质量,你认为________.(填入一个选项的字母)
A.前面提供的数据已经足够
B.还需要提供100℃时溶液的密度(![]() )
)
C.还需要提供结晶后剩余溶液的体积(10.0 mL)
(6)根据第(5)小题你的选择(如选A,则直接计算,如选B或C可选用其数据)计算从10℃,30.0 mL溶液中结晶而析出的![]() 的质量.
的质量.
参考答案
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、![]() 、
、![]() (2)D、
(2)D、![]() 、
、![]() (3)A、
(3)A、![]() 、
、![]() (4)D、
(4)D、![]() 、
、![]() .
.
24.①![]()
②![]()
③![]()
④![]()
25.(1)磺酸基![]() H亦有较强的酸性
H亦有较强的酸性
(2)A ![]()
(3)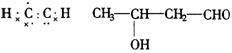
![]()
26.(1)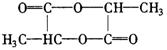
(2)![]()
(3)②⑤
(4)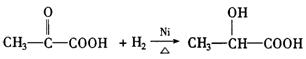
n 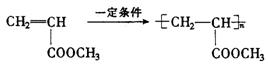
27.(1)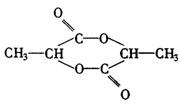
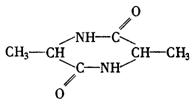
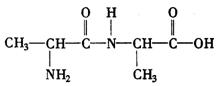
(2)①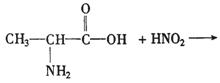
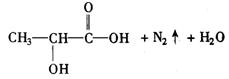
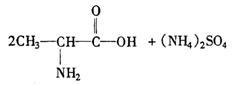
②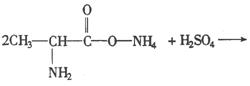
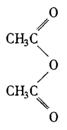
28.本题采用“逆推法”(1)A
 B
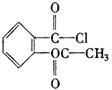
B
(2)①②③④
29.
(2)可以,因为该反应的总反应式为![]() ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D
(2)除去过量的硫粉 (3)![]()
(4)![]() 生成
生成![]() :
:![]() ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 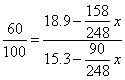
∴ x=23.1(g)