2001北京市著名重点中学高考模拟试卷精选化学(第三模拟)
第Ⅰ卷 (选择题共83分)
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
1.我国农业因遭受酸雨而造成每年损失高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
你认为减少酸雨产生的途径可采取的措施是 [ ]
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化土壤中加石灰;⑤开发新能源。
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤
2.下列变化中属物理变化的是 [ ]
A.石墨变为金刚石
B.NaCl水溶液导电
C.由于冰得到二氧化碳
D.二氧化硫使品红溶液褪色
3.自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是 [ ]
A.铜水龙头
B.铁水龙头
C.塑料水龙头
D.陶瓷水龙头
4.生活中遇到的某些问题,常常涉及到化学知识。下列各项叙述不正确的是 [ ]
A.鱼虾放置时间过久,会产生不愉快的腥臭气味,应当用水冲洗,并在烹调时加入少量食醋
B.“酸可以除锈”,“洗涤剂可以去油”都是发生了化学变化
C.被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁叮咬人的皮肤时将甲酸注入人体的缘故,此时,若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛
D.煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可以使蛋白质发生变性凝固
5.质量相等的石墨与足球烯(C60)所含质子数 [ ]
A.前者多
B.相等
C.后者多
D.无法确定
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
6.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该新元素的下列叙述正确的是
[ ]
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277∶12
7.为了除去镀在铝表面的铜镀层,可选用的试剂为 [ ]
A.浓硫酸
B.稀HNO3
C.NaOH溶液
D.浓HNO3
8.实验室用图3-1装置分离CO2和CO气体并干燥。
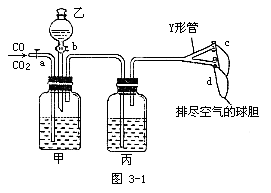
图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆。现装置内的空气已排尽。为使实验成功,甲、乙、丙分别盛放的溶液是 [ ]
A.NaHCO3饱和溶液12mol/L盐酸18.4 mol/L H2SO4
B.NaOH饱和溶液2mol/L H2SO418.4 mol/L H2SO4
C.Na2CO3饱和溶液2 mol/L H2SO4NaOH饱和溶液
D.18.4 mol/L H2SO4NaOH饱和溶液18.4 mol/L H2SO4
9.CaC2和MgC2都是离子化合物,下列叙述中正确的是 [ ]
A.CaC2和MgC2都能跟水反应生成乙炔
![]()
![]()
D.MgC2的熔点低,可能在100℃以下
10.重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-1g[D+],以下关于pD的叙述中,正确的是 [ ]
A.中性溶液中pD=7.0
B.含0.01 mol的NaOD的D2O的溶液1L,其中pD= 12.0
C.溶解0.01 molDCl的D2O的溶液1L,其pD=2.0
D.在100ml 0.25 mol/ L的 DCl重水溶液中,加入 50ml0. 2 mol/L的NaOD的重水溶液,所得溶液的 pD=1.0
11.在短周期中的X和Y两种元素可组成化合物XY3,则下列说法正确的是 [ ]
A.若X的原子序数是m,则Y的原子序数必定是m+4
B.XY3晶体一定属于离子晶体
C.X与Y可属于两个不同周期,也可属于同一周期
D.X的原子半径小于Y的原子半径
12.下列离子方程式书写正确的是 [ ]
A.过量氯气通入溴化亚铁溶液中
3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
B.过量二氧化碳通入偏铝酸钠溶液中
![]()
C.在溶液中亚硫酸氢铵与等物质的量的氢氧化钠混合
![]()
D.碳酸氢镁溶液中加入过量石灰水
![]()
13.取 1molA和a molB,按 A(气)+aB(气)
![]() bC(气)进行反应,当A的转化率为50%时,同温同压下,测得混合气体的密
bC(气)进行反应,当A的转化率为50%时,同温同压下,测得混合气体的密
![]()
[ ]
A.a=2,b=1
B.a=3,b=3
C.a=3,b=2
D.a=2,b=3
三、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意)
14.X和Y均是短周期元素,它们之间可形成化合物X2Y3。若已知 X的原子序数为n,则Y的原子序数不可能是 [ ]
A.n+1
B.n-5
C.n+3
D.n+6
15.镭是元素周期表中第七周期、第 ⅡA族元素,下列关于镭的性质的描述中不正确的是 [ ]
A.镭比钙金属性强,与卤素形成离子化合物,在化合物中镭显+2价
B.镭单质与水反应,可放出H2
C.镭的碳酸盐难溶于水
D.镭的氢氧化物呈两性
16.在一密闭容器中进行反应:2SO2(气)+O2(气)
![]() 2SO3(固)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2 mol/L。当反应达平衡时,可能存在的数据是 [ ]
2SO3(固)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2 mol/L。当反应达平衡时,可能存在的数据是 [ ]
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO2为0.25 mol/L
C.SO2、SO3均为0.15 mol/L
D.SO3为0.4 mol/L
17.下列现象不能用胶体的知识解释的是 [ ]
A.牛油与NaOH溶液共煮,向反应后所得液体中加入食盐,会有固体析出
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.向FeCl3溶液中加入Na2CO3溶液,会出现红褐色沉淀
D.在河水与海水的交界处,有三角洲形成
18.图3-2中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 [ ]



原剂的物质的量之比为5∶2。则n的值是 [ ]
A.1
B.2
C.3
D.4
20.某化工厂排放的酸性废液里含有游离的氯。要除去游离氯并中和其酸性,正确方案是 [ ]
A.先加适量的Na2SO3,再加适量的NaOH
B.先加适量的NaOH,再加适量的Na2SO3
C.先加过量的Na2SO3,再加适量的NaOH
D.先加过量的NaOH,再加适量的HCl
![]()
水,溶液无色。因此可知原溶液中 [ ]
A.肯定不含I-
B.肯定不含Cl-
C.肯定含Fe3+
![]()
22.已知丁基共有4种。不必试写,立即可断定分子式为C5H10O的醛应有 [ ]
A.3种
B.4种
C.5种
D.6种
第Ⅱ卷 (非选择题共67分)
四、(本题包括2小题,共20分)
23.(6分)一位同学使用①冷开水②碘酒③熟石灰④淀粉⑤肥皂水⑥食醋⑦红墨水⑧废易拉罐(铝合金)⑨废干电池(锌筒里装填有碳粉、二氧化锰、氯化铵、淀粉等物质的糊状混合物)⑩食盐(11)纯碱 为实验试剂,进行家庭小实验。
(1)用给定的试剂,他不能进行的实验是(不考虑电解):____。(填写标号)
a.制NaOH溶液b.制备纯净氯气并实验它的漂白作用c.实验硬水和肥皂的作用d.制二氧化碳
e.制硬脂酸f.进行淀粉水解实验并检验水解产物
(2)该同学制备氨气,先从废干电池中制备氯化铵。为此,他准备把废干电池锌筒里的糊状混合物溶解于少量水,过滤去除不溶物,再蒸发灼烧滤液,以制得干燥的氯化铵晶体。他的设想是否合理____,理由是____________。
(3)该同学拟进行除去淀粉溶液中所含食盐的实验。他把一只鸭蛋浸泡在食醋里,待蛋壳溶去,在膜上打一小洞,小心倒出蛋清、蛋黄,洗净蛋膜,作为半透膜小袋,再装入含食盐的淀粉溶液,扎好袋口。做好这些准备工作后,他即将进行的实验操作名称是____(选填:萃取、盐析、渗析、过滤、分液)要保证全部除去淀粉溶液里的食盐,实验中必须____。
食醋溶去蛋壳发生的反应的离子方程式是____。
24.(14分)硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用题给出的仪器、药品(如图3-3所示)设计一个实验,测定硫酸铜在加热分解时产生的氧气、二氧化硫、三氧化硫与参加反应的硫酸铜的物质的量的关系,并确定在该条件下硫酸铜分解反应的化学方程式。
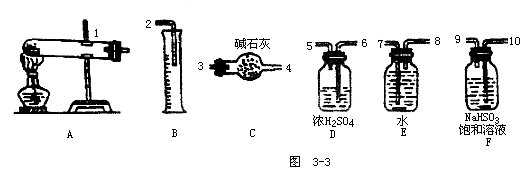
实验测得数据和有关结果如下:
①准确称量无水硫酸铜4.80g;
②测出量筒中水的体积(折算成标准状况下气体的体积)为 224 mL;
③干燥管在实验后质量增加2.56g;
④实验结束时装置F中的溶液变为Na2SO4溶液(不含其他杂质)。
(分子量:CuSO4160 SO264 SO380)
请回答:
(1)硫酸铜加热分解产生的混和气体首先通过____(填序号)装置,发生反应的化学方程式为______。
(2)若气流从左→右,分解后混和气体依次通过装置的顺序(填进出口序号)为____。
(3)装置D的作用____,装置C的作用____。
(4)根据测得数据,确定该条件下硫酸铜分解反应的化学方程式为:____。
五、(本题包括2小题,共17分)
25.(9分)由常见元素组成的化合物A、B、C、D、E、F、G有如下图关系,其中C、F、G是无色化合物,D是氯化物。若在D或E的纯溶液中通入F气体,都有B和G生成。
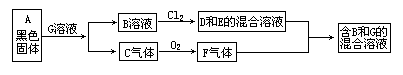
(1)写出下列物质的化学式A____,B____,C____,G____。
(2)写出将F通入D和E的混合溶液中发生反应的离子方程式________。
(3)D溶液中通入C气体,则产生浅黄色浑浊,写出该反应的化学方程式。___________。
26.(8分)已经知25℃时几种物质的电离度(溶液浓度为0.1mol)如下表:

(已知(H2SO4的第一步是完全电离的)
(1)25℃时,0.1mol/L上述几种溶液[H+]由大到小的顺序是(填序号)____;
(2)25℃时,pH值相同的上述几种溶液,其物质的量浓度由大到小的顺序是____;
(3)25℃时,将足量的 Zn粉放入等体积、pH=1的上述几种溶液中产生氢气的体积(同温同压下),由大到小顺序为____;
![]()
![]()
六、(本题包括2小题,共15分)
27.(10分)化合物A(C8H8O3)为无色液态,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。
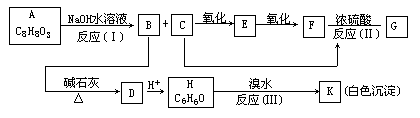
(1)下列化合物可能的结构简式:A____,E____,K____。
(2)反应类型(Ⅰ)____(Ⅱ)____(Ⅲ)____。
(3)反应方程式:H→K:_________
C→E:_________
C+F→G:_________。
28.A、B两种有机化合物,分子式都是C9H11O2N。化合物A是天然蛋白质的水解产物,光谱测定显示:分子结构中不存在甲基(—CH3),化合物A的结构式是_____。化合物B是某分子式为C9H12的芳香烃—硝化后的唯一产物(硝基连在芳环上)。化合物B的结构简式是______。
七、(本题包括2小题,共15分)
29.(6分)现有MgSO4和Al2(SO4)3的混合溶液,其中Mg2+
![]()
Mg2+与Al3+分离,至少应加入1.6 mol/L的NaOH溶液体积为多少?
30.(9分)向 8g某一价或二价金属的氧化物固体中加入适量10%的稀H2SO4(密度为1.07g/cm3),使其完全溶解,已知所消耗的硫酸体积为92mL。在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电完毕后硫酸溶液的物质的量浓度。(溶液体积以消耗的硫酸体积92mL为准)