高考化学课前选择题练习(18)
2008年4月9日 编辑:熊维平
1.下列实验操作能够达到目的的是
A.用托盘天平称取25.20 gNaCl固体
B.用湿润的蓝色石蕊试纸检验NH3
C.用湿润的pH试纸测定某溶液的pH
D.用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液
|
A.12g C60中含有60NA个电子
B.1mol HNO3见光分解,转移电子数为4NA
C.48g O2和48g O3含有的原子数分别为2NA和3NA
D.60g SiO2高温下与足量纯碱反应最多可释放出的气体分子数为NA
3.下列反应所得溶液中一定只含一种溶质的是
A.向稀硝酸中加入铁粉
B.向稀盐酸中加入少量的NaAlO2溶液
C.向NaOH溶液中通人CO2气体
D.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
4.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃很硬属于原子晶体
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
5.下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是
A.FeBr2 与 Cl2
B.Ca(HCO3)2 与NaOH
C.HCl与Na2CO3
D.Ba(NO3)2 与Na2SO4
6.下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
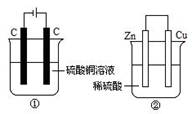 A.产生气体体积 ①=②
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑
②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
7.常温下,将V1mL C1mol/L的氨水滴加到V2mL C2mol/L的盐酸中,下列结论正确的是
A.若V1=V2,且溶液的pH<7.则一定有C1<C2
B.若C1=C2 V1=V2,则混合液中c(NH4+)=c(C1-)
C.若混合液的pH=7.则混合液中c(NH4+)>c(C1-)
D.若混合液的pH=7.则混合液中C1V1=C2V2
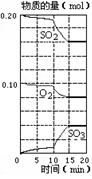 8.在一定条件下,二氧化硫和氧气发生如下反应:
8.在一定条件下,二氧化硫和氧气发生如下反应:
![]() 2SO2(g)+ O2
(g) 2SO3(g)
;△H<0。600℃时,
2SO2(g)+ O2
(g) 2SO3(g)
;△H<0。600℃时,
在某密闭容器中,将二氧化硫和氧气混合,反应过程中
SO2、O2、SO3物质的量有如图所示的变化。其中10 mi
n到15 min时,与图像不相符的变化是
A.加了催化剂
B.增加SO3的物质的量
C.升高温度
D.缩小容器体积
9.分子式为C8H6O2(除苯环外,不含其它环),其同分异构体中,可能含有的官能团是
①一个醛基 ②两个醛基 ③两个羟基 ④一个羰基 ⑤一个羧基
A.①②④ B.①④⑤ C.①②③④ D.①②④⑤
10.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3 kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol
4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol
下列结论正确的是
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.碳的燃烧热大于110.5 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 姓名 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|