高二化学物质结构与性质试题
第I卷 (选择题,共48分)
一、单项选择题(本题包括8小题,每小题3分,共24分。)
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A.![]() C
B.
C
B.![]() N
C.
N
C.![]() O
D.
O
D.![]() P
P
2.有关化学用语正确的是
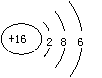 A.Cl-的电子排布式:1s22s22p63s23p6
B.乙醇的结构简式:C2H6O
A.Cl-的电子排布式:1s22s22p63s23p6
B.乙醇的结构简式:C2H6O
![]()
C.硫离子的结构示意图: D.四氯化碳的电子式:
3.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
4.下列关于元素第一电离能的说法不正确的是
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的逐级电离能越来越大
5.具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p3 B.1s22s22p3
C.1s22s22p4 D.1s22s22p63s23p4
6.下列分子中,所有原子都满足8电子结构的是
A.六氟化硫 B.光气(COCl2)
C.二氟化氙 D.三氟化硼
7.下列说法中正确的是
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
8.下列关于丙烯(CH3—CH =CH2)的说法正确的是
A.丙烯分子有8个δ键,1 个∏键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子不存在非极性键
D.丙烯分子中3个碳原子可能在同一直线上
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。)
9.1919年,Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征。下列各对粒子中,空间结构相似的是
A.CS2与NO2 B.CO2与N2O C.SO2与O3 D.PCl3与BF3
10.下列说法不正确的是
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键
C. I2易溶于CCl4可以用相似相溶原理解释
D. 甲烷可与水形成氢键这种化学键
11.关于晶体的下列说法正确的是:
A.任何晶体中,若含有阳离子就一定有阴离子。
B.原子晶体中只含有共价键。
C.原子晶体的熔点一定比金属晶体的高。
D.离子晶体中只含有离子键,不含有共价键。
12.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是
A.X:3s23P1 Y:3s23P5 B.X:2s22P3 Y:2s22P4
C.X:3s23P1 Y:3s23P4 D.X:3s2 Y:2s22P3
13.下列各组中的X和Y两种原子,化学性质一定相似的是
A.X原子和Y原子最外层都只有一个电子
B.X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
 D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
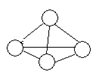
14.白磷分子如右图所示,则31g白磷分子中存在的共价键数目是:
(NA表示阿佛加德罗常数的值)P-31
A.4NA B.NA C.1.5NA D.0.25NA
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
第Ⅱ卷(非选择题,共72分)
三、填空题(共22分)
15.(6分)现有下列物质, 用编号填空回答下列各问:
A.干冰 B.金刚石 C. 氩 D.晶体硅 E.过氧化钠 F.二氧化硅G. 氯化铵
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)属于分子晶体,且分子为直线型结构的是 。
(4)由原子构成的分子晶体是 。
(5)含有非极性键的离子化合物是 。
(6)含有离子键、共价键、配位键的化合物是 。
16.(6分)某元素的激发态原子的电子排布式为1s![]() 2s
2s![]() 2p
2p![]() 3s
3s![]() 3p
3p![]() 4s
4s![]() ,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是 。
,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是 。
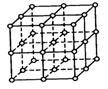 17.(10分)按要求完成下列各小题:
17.(10分)按要求完成下列各小题:
⑴如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑休积的大小)。请将其中代表Na+的圆圈涂黑,以完成NaCl晶体的结构示意图。
⑵干冰晶体中,每个CO2所处的位置与NaCl晶体中Na+或Cl-的位置相同。干冰晶体中,在每个CO2分子的周围与它最接近的且距离相等的CO2分子共有__________个。
⑶碳化硅(SiC)是一种具有类似金刚石结构的晶体,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是_______(填序号)。
⑷C60固体与金刚石熔点更高的是________,原因是____________________ __________。
四、实验题(共16分)
18.(10分)实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液
⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
| 实验方案 (只填写选用试剂序号) | 实验现象 | 结论 | |
| ⑴ |
| 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: |
| ⑵ |
|
| 非金属性:Cl>Br |
写出实验(2)中所发生的离子反应方程式
19.(6分)Co(NH3)5BrSO4可形成两种钴的配合物 ,已知Co3+ 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为 ,第二种配合物的结构式为 ,如果在第二种配合物溶液中滴加AgNO3溶液时,产生 现象。
五、推断题(共34分)
20.(12分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | |||||||||||||||||
| f | h | i | |||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | k | ||||||||||||||
| l | |||||||||||||||||
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式 ;
(3)请比较b、e、j三种元素的电负性由大到小的顺序 (写元素符号);此三种元素的第一电离能由大到小的顺序 (写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式 ;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出k、l的互化物的电子式 ,它是由 键(根据原子轨道的重叠程度填写)形成的 化合物(填“离子”或“共价”)。
21.(9分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,
理由是
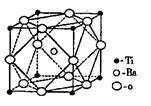
22.(13分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有![]() Ti和
Ti和![]() Ti两种原子,它们互称为
。Ti元素在元素周期表
Ti两种原子,它们互称为
。Ti元素在元素周期表
中的位置是第 周期,第 族;基态原子的电子排布式
为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
|
酸钡晶体中晶胞的结构如右图所示,它的化学式是
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配
离子[TiCl(H2O)5]2+中含有的化学键类型是 、
该配合物的配体是 、 。
参考答案及评分标准
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | C | A | A | B | A | B | A | A | BC | D | B | BC | C | C |
15 (1)BD (2)AC (3)A (4)C (5)E (6)G
16 1s22s22p63s23p4;S;H2SO4。
17.(1)略 (2)12 (3)132
(4)金刚石 金刚石是原子晶体,而C60固体是分子晶体,原子晶体的熔点高于分子晶体
18、(每空2分,共10分)
| 实验方案 (只填写选用试剂序号) | 实验现象 | 结论 | |
| ⑴ | ③ ④ ⑤ | 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: Mg>Al |
| ⑵ | ⑥ ⑧ | 溶液由无色变为黄色(或橙黄) | 非金属性:Cl>Br |
Cl2 + 2Br- = 2Cl- + Br2
19.[Co(NH3)5Br] SO4 和[Co (SO4) (NH3)5] Br,淡黄色沉淀
20、(1)、1s22s22p63s23p63d5(2分)(2)、Cl2+H2O=HCl+HClO (2分)
(3)、Cl>Al>Mg, Cl>Mg>Al (4)、Al(OH)3+OH-=AlO2-+2H2O(2分)
(5)、:·· ·· : ·· ·· :(2分) σ 共价 其余各1分
21.(1)16 146C (2)[![]() ]+
(2分) (3)Cl b
]+
(2分) (3)Cl b
(4)H2CO3 弱酸性或非氧化性酸(2分),其余均为1分
22.(1)同位素(2分) 四(1分);IVB族(1分);
1s2 2s2 2p6 3s2 3p6 3d2 4s2(或[Ar]3d2 4s2(2分)
d(1分)
(2)BaTiO3(2分) (3)极性共价键(或共价键)、配位键(2分);
H2O、Cl—(2分)