高二化学下学期期末联考试卷
高二化学试卷
命题学校:武汉三中 命题教师:陈涛 审题教师:刘炳荣 陈晓华
考试时间:年6月26日下午 2:00—3:30
说明:本试卷分为第I卷和第II卷两部分,第I卷为选择题,第II卷为非选择题,所有试题的答案均填写在答题卷上,答案写在试卷上的无效。本试卷满分110分,考试时间90分钟。
可能用到的相对原子质量:H-1 O-16 C-12 Cu-64 S-32 Ba-137
第I卷(选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1、下列叙述,从化学角度分析正确的是( )
A、木材、棉花、羊毛、尼龙都属于天然纤维,而锦纶、碳纤维、光导纤维则属于合成纤维
B、煤气化技术的使用,虽然能达到减少二氧化硫和烟尘排放的目的,但不能提高煤的燃烧效率
C、食用植物油的主要成分是高级饱和脂肪酸甘油酯,是人体的营养物质
D、改进塑料的配方和生产工艺,研究开发易分解的新型塑料,如淀粉塑料、水溶塑料、光解塑料等是治理“白色污染”的发展方向
2、2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷。已知丙烷的燃烧热为 2221.5 KJ/mol,下列有关说法不正确的是( )
A、丙烷的沸点比正丁烷低
B、奥运火炬燃烧主要是将化学能转变为热能和光能
C、丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D、丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)====3CO2(g)+4H2O(1);
![]() 2 221.5 kJ/mol
2 221.5 kJ/mol
3、下列高分子材料与其用途对应关系不正确的是( )
|
| 材料 | 用途 |
| A | 聚乙烯 | 食品袋、包装袋 |
| B | 合成橡胶 | 橡皮管、轮胎 |
| C | 硅聚合物、聚氨酯 | 人工心脏等人造器官 |
| D | 玻璃钢 | 高强度导电材料 |
4、下列各组物质中,化学键类型相同,晶体类型也相同的是( )
A、C(金刚石)和CO2 B、NaBr和HBr
C、CH4和H2O D、Na2O2和H2O2
5、下列叙述正确的是( )
A、原子晶体都是单质,晶体中只含有共价键
B、离子晶体都是化合物,晶体中只含有离子键,不含有共价键
C、分子晶体既有单质又有化合物,晶体中只存在分子间作用力,不含有其他化学键
D、金属晶体都是单质,晶体中含有阳离子,但不含有阴离子
6、下列事实与氢键有关的是( )
①NH3易液化;②氧族元素的氢化物中,H2O的沸点最高;③卤族元素的氢化物中,HF的稳定性最强;④冰的密度比水小;⑤H2S的还原性强于H2O
A、①②③ B、①②④ C、①②③④ D、全部
7、下列反应中,既属于离子反应,又属于氧化还原反应的是( )
①往Na2SO3溶液中加入用硝酸酸化的BaCl2溶液;②往KNO3与稀硫酸的混合溶液中加入铜片;③往FeCl3溶液中滴加Na2S溶液至过量;④铝热反应;⑤FeCl3溶液遇KSCN溶液变红;⑥NH4Cl与Ca(OH)2共热制NH3
A、①②③ B、①②③⑤ C、②③⑤ D、全部
8、下列高分子化合物必须由两种单体缩聚而成的是( )
 A、[ CH2—CH2—CH—CH2 ]n B、[ NH(CH2)6NH—
A、[ CH2—CH2—CH—CH2 ]n B、[ NH(CH2)6NH—![]() (CH2)4—
(CH2)4—![]() ]n
]n
C、[ O—CH—![]() ]n
D、 (C6H10O5)n
]n
D、 (C6H10O5)n
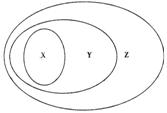 9、下列选项中不能用如图表示物质或概念间从属关系的是( )
9、下列选项中不能用如图表示物质或概念间从属关系的是( )
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 电解质 | 离子化合物 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
10、科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25℃、1×105 Pa时,石墨、一氧化碳的燃烧热分别是393.5 kJ·mol-1和283.0 KJ·mol-1,下列说法或方程式正确的是( )
A、在相同条件下:2C(石墨)+O2(g)====2CO(g);![]() 110.5 kJ·mol-1
110.5 kJ·mol-1
B、1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C、在相同条件下:C(石墨)+CO2(g)====2CO(g);![]() 172.5 kJ·mol-1
172.5 kJ·mol-1
D、若金刚石的燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热
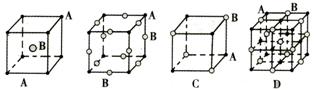
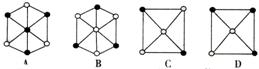
11、现有四种晶体,其离子排列方式如图所示,其中化学式不属于AB型的是( )
12、化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A、钢铁腐蚀时可能发生反应(正极):2H2O+O2-4e-====4OH-
B、1 L 0.5 mol/L稀硫酸与1 L 1 mol/L NaOH溶液反应放出57.3 kJ的热
H2SO4(aq)+2NaOH(aq)====Na2SO4(aq)+2H2O(1);![]() 114.6 kJ/mol
114.6 kJ/mol
C、碳酸氢铵溶液与足量的烧碱溶液反应:NH![]() +OH-====NH3·H2O
+OH-====NH3·H2O
D、碳酸氢钠溶液与足量澄清石灰水反应:HCO![]() +Ca2++OH-====CaCO3↓+H2O
+Ca2++OH-====CaCO3↓+H2O
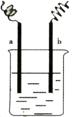 13、右图中,两电极上发生的电极反应式如下:a极:2H++2e-====H2↑,
13、右图中,两电极上发生的电极反应式如下:a极:2H++2e-====H2↑,
b极:Fe―2e―====Fe2+,则下列说法不合理的是( )
A、该装置可能是电解池
B、溶液pH可能变大
C、a、b可能是同种电极材料
D、该过程中能量的转换一定是化学能转化为电能
14、已知2Fe3++2I-=2 Fe2++I2, 2Fe2++Br2=2 Fe3++2Br—,往FeI2、FeBr2的混合溶液中通入一定量Cl2,充分反应后,下列说法正确的是( )
A、若溶液中有Fe3+,则一定无Br— B、若溶液中有I2,则一定无Fe2+
C、若溶液中有Br—,则一定无I- D、若溶液中无Fe2+,则一定无Br-
15、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32―、SO42―,现取三份100 mL上述溶液分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A、K+一定存在 B、100 mL溶液中含0.01 molCO32-
C、Cl-一定存在 D、Ba2+一定不存在,Mg2+可能存在
16、下列判断正确的是( )
A、任何胶体中加入可溶性电解质后,都能使胶体粒子凝聚成较大颗粒形成沉淀析出
B、胶体与其他分散系的本质区别是分散质粒子直径在1nm~100 nm之间
C、因为胶粒比溶液中溶质粒子大,所以可以用过滤的方法把胶体中的胶粒分离出来
D、溶液是均一稳定的混合物,而胶体和浊液则是不均一、不稳定的混合物
17、X、Y、Z为短周期主族元素,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y原子最外层电子数多3。下列叙述正确的是( )
A、原子半径的大小顺序:Z>Y>X
B、Z单质与X单质直接反应可生成两种化合物
C、工业上,电解X和Y形成的化合物制取Y单质
D、Y、Z元素的最高价氧化物对应的水化物不能互相反应
18、以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为( )
A、0.1 mol B、0.2 mol C、0.3 mol D、0.4 mol
第II卷(非选择题 共56分)
19、(10分)(1)化学上常用的除杂或提纯的方法有: ①溶解过滤;②蒸发结晶;③冷却结晶;④加热(或灼烧);⑤蒸馏(或分馏);⑥洗气;⑦盐析;⑧渗析;⑨萃取分液;⑩升华等,欲除去下列各组混合物中的杂质,(括号中为杂质),请选择合适的主要方法,将其序号填写在相应的空白处:
A、Na2CO3(BaCO3) B、CaO(CaCO3)
C、NaCl(NH4Cl) D、KCl(KNO3)
E、蛋白质[(NH4)2SO4] F、CO2(SO2)
G、苯(甲苯) H、水(碘)
(2)下列有关实验操作会导致所测结果偏大的是
①在测定硫酸铜晶体里结晶水含量的实验中,加热时有少量晶体溅出坩埚;
②在测定硫酸铜晶体里结晶水含量的实验中,当蓝色晶体完全变成白色粉末且不再有水蒸气逸出后,熄灭酒精灯,待坩埚在泥三角上自然冷却后再称量;
③在中和热的测定实验中,将盐酸与氢氧化钠溶液混合后,没有迅速盖上盖板并及时搅拌;
④在中和热的测定实验中,用浓硫酸代替了等体积的稀盐酸;
⑤在用标准盐酸滴定某氢氧化钠溶液测定其物质的量浓度的实验中,用酚酞作指示剂;
⑥在用标准盐酸滴定某氢氧化钠溶液测定其物质的量浓度的实验中,所取出的氢氧化钠溶液在空气中露置时间过长。
20、(9分)A、B、C、D都是短周期主族元素,原子序数依次增大,A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体。B的阴离子与C的阳离子跟氖原子的电子层结构相同。D和A两元素可形成D2A3化合物,该化合物既能溶于强酸又能溶于强碱。试回答下列问题:
(1)C在A2中燃烧生成淡黄色固体Y。Y的电子式为: 。Y的晶体是 晶体,晶体中阳离子与阴离子的个数比为 。
(2)C和B的氢化物的水溶液反应可放出一种无色气体,请写出该反应的离子方程式:
。
(3)若D和Mg与NaOH溶液构成原电池,写出该原电池的负极反应式:
。
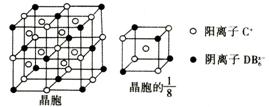 (4)B、C、D可组成离子化合物CxDB6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子C+(用○表示)位于正方体的棱的中点和正方体内部;阴离子DB
(4)B、C、D可组成离子化合物CxDB6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子C+(用○表示)位于正方体的棱的中点和正方体内部;阴离子DB![]() 用●表示)位于该正方体的顶点和面心,该化合物的化学式是
。
用●表示)位于该正方体的顶点和面心,该化合物的化学式是
。
(5)如图A、B、C、D是其晶胞的1/8沿体对角线方向在纸平面上的投影,其中能正确反映微粒位置关系的是 。
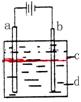
21、(15分)Ⅰ、某研究性学习小组的同学设计右图所示实验装置制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
(1)b极材料为 。
(2)电解液d可以是下列物质中的 (填字母代号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)写出a、b两电极上的电极反应式a极: 、b极: 。
Ⅱ、草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。
(1)写出草酸晶体受热分解的化学方程式:
。
 (2)将a g草酸晶体加热至完全分解时,所得气体的平均相对分子质量为
。
(2)将a g草酸晶体加热至完全分解时,所得气体的平均相对分子质量为
。
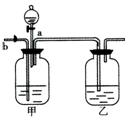
(3)实验可用右图装置将CO2和CO进行分离和干燥。已知a、b均为活塞,试回答:①甲瓶中应装 溶液,乙瓶中装的是 ,分液漏斗中应装 。
②当CO2和CO混合气体通过该装置时,先分离得到的气体是 ,活塞操作顺序是:关闭 ,打开 。
22、(10分)有机化合物A的分子式是C13H20O8(相对分子质量为304),1 mol A在酸性条件下水解得到4 mol CH3COOH和1 mol B。B分子结构中每一个连有羟基的碳原子上还连有两个氢原子。
请回答下列问题:
(1)A与B的相对分子质量之差是 。
(2)B的结构简式是: 。
(3)B不能发生的反应是 (填写序号)。
①氧化反应 ②取代反应 ③消去反应 ④加聚反应
(4)已知:
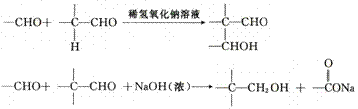
 以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B 的各步反应的化学方程式。
以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B 的各步反应的化学方程式。
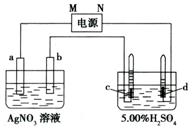
23、(12分)图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,a、b两极上无气体,在c、d两极上共收集到336 mL(标准状况)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d上分别生成的物质的量之比为:2: : : 。
(4)AgNO3溶液的浓度 ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。(均填“增大”、“减小”或“不变”)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液质量为 g。

高二化学答题卡
Ⅰ卷选择题:(每题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
Ⅱ卷(非选择题,共56分)
19、(10分)
(1)A、 B、 C、 D、 E、 F、 G、 H、
(2)
20、(9分)
(1) ; ;
(2)
(3)
(4) (5)
21、(15分)
I、(1) (2)
(3) ;
。
(4)a极 b极
II、(1)
(2)
(3)① ; ;
② ; ;
22、(10分)
(1) (2) (3)
(4)
23、(12分)
(1) (2) ;
(3) : :
(4) ; ; ;
(5)
高二化学参考答案
Ⅰ卷选择题:(每题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | D | C | D | B | A | B | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | B | D | D | C | A | B | C | D |
Ⅱ卷(非选择题,共56分)
19、(10分,每空1分)
(1)A、 ① B、 ④ C、④ D、 ③ E、 ⑧ F、 ⑥ G、 ⑤ H、 ⑨
(2) ①④
20、(9分,第2、5问2分,其余每空1分)
(1) Na+[:O:O:]2-Na+ 、 离子 、 2:1
(2) 2Na+2HF=2Na++2F-+H2↑
(3) Al―3e―+4OH-=AlO2-+2H2O
(4) Na3AlF6 (5) A、B
21、(15分,第2问2分,其余每空1分)
I、(1) 石墨 (2) B、C
(3) 隔绝空气,防止Fe(OH)2被氧化 ;
除去溶液中溶解的O2,防止Fe(OH)2被氧化 。
(4)a极 Fe―2e―+2OH―=Fe(OH)2 b极 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
II、(1) H2C2O4·2H2O![]() 3H2O↑+CO↑+CO2↑
3H2O↑+CO↑+CO2↑
(2) 25.2
(3)① NaOH 、 浓硫酸 、 稀硫酸(其他合理答案亦可)
② CO 、 a 、 b
22、(10分,每空2分)
(1) 168 (2) C(CH2OH)4 (3) ③④
(4) CH3CHO+3HCHO![]() (CH2OH)3CCHO
(CH2OH)3CCHO
(CH2OH)3CCHO+HCHO+NaOH(浓)→C(CH2OH)4+HCOONa
23、(12分,第5问2分,其余每空1分)
(1) 正 (2) Ag 、 2.16
(3) 2:0.5:1
(4) 不变 、 不变 、 增大 、 减小
(5) 45.18