高二化学下学期期末质量检测考试
高二化学试题
注意事项:
1、时间:90分钟,满分:100分。
2、本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分(请把Ⅰ卷答案涂在答案卡上)。第Ⅰ卷1——5页,第Ⅱ卷6——8页。
3、答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目、试卷类型用铅笔涂写在答案卡上。
可能用到的相对原子质量:H:1 O:16 S:32 Na:23 Cu:64 C:12 Mg:24
第Ⅰ卷(选择题,共63分)
一、 选择题(本题包括21个小题,每小题3分,共63分。每小题只有1个选项符合题意。)
( )1、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH—(aq)=H2O(l) △H= —57.3KJ·mol-1 分别向1L0.5mol/L的NaOH溶液中加入:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应的△H的绝对值分别为
△H1 △H2 △H3,它们的关系正确的是
A、 △H1>△H2>△H 3 B、 △H2<△H1<△H3
C、 △H1=△H2=△H3 D、 △H2>△H3>△H1
 ( )2、如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
( )2、如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是
A.右边的电极为电池的负极,b处通入的是空气
B.右边的电极为电池的负极,b处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
( )3、相同条件下,通过相同的电量分别电解CuCl2和AgNO3,当生成1mol Cu时,则析出Ag的质量是
高一化学试题 (共8页) 第1页
A、108g B、54g C、216g D、64g
( )4、在密闭容器中,对于反应:![]() ,在反应起始时
,在反应起始时![]() 和
和![]() 分别为10mol和30mol,当达到平衡时,
分别为10mol和30mol,当达到平衡时,![]() 的转化率为30%。. 若以
的转化率为30%。. 若以![]() 为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则
为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则![]() 的起始物质的量和它的转化率,正确的是
的起始物质的量和它的转化率,正确的是
A. 40mol;35% B. 20mol;30% C. 20mol;70% D. 10mol;50%
( )5、本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
( )6、对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
( )7、往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)![]() 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
 A.容器内气体颜色变深,平均相对分子质量不变
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象为(如右图)
( )8、在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下
高一化学试题 (共8页) 第2页
发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
 | |||
 | |||
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
( )9、向固定容积为1L的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)![]() 3C(g)+D(s),达到平衡时,C的浓度为1.2
mol·L—1。若维持容器的体积和温度不变,按下列方式改变起始物质及其物质的量,则达到平衡时,C的浓度为2.4
mol·L—1的是
3C(g)+D(s),达到平衡时,C的浓度为1.2
mol·L—1。若维持容器的体积和温度不变,按下列方式改变起始物质及其物质的量,则达到平衡时,C的浓度为2.4
mol·L—1的是
A、4molA+2molB+1molC B、3molC+1molD+1molB
C、6molC+2.5molD D、1.6molA+0.8molB+0.6molC+0.3molD
( )10、化学反应4A(s)+3B(g)![]() 2C(g)+D(g),经过2minB的浓度减小0.6
mol/L.。此反应速率的表示正确的是
2C(g)+D(g),经过2minB的浓度减小0.6
mol/L.。此反应速率的表示正确的是
A、用A表示的反应速率是0.4mol/L·min—1
B、分别用B、C、D表示的化学反应速率,其比值是3:2:1
C、在2 min末的反应速率,用B表示是0.3mol/L·min—1
D、在2 min内用B和C表示的反应速率的值都是逐渐减少的。
( )11、将下列四组溶液在烧杯中分别同时迅速混合,此时,硫代硫酸钠和盐酸缓慢的进行反应,则出现浑浊的先后顺序是
①20℃时,10ml5.4mol·L—1的Na2S2O3溶液和20ml1.5 mol·L—1的盐酸
②20℃时,10ml4.0 mol·L—1的Na2S2O3溶液和10ml2.0 mol·L—1的盐酸
③30℃时,15ml3.5 mol·L—1的Na2S2O3溶液和10ml2.5 mol·L—1的盐酸
④30℃时,20ml3.0 mol·L—1的Na2S2O3溶液和10ml3.0 mol·L—1的盐酸
A、③④②① B、④③②① C、①②③④ D、④①③②
高一化学试题 (共8页) 第3页
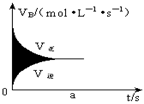 ( )12、如图,在容积固定的密闭容器中发生可逆反应A(g)+2B(g)
( )12、如图,在容积固定的密闭容器中发生可逆反应A(g)+2B(g)![]() 2C(g),则图中阴影部分的面积可表示为
2C(g),则图中阴影部分的面积可表示为
A、 t时间内消耗B的物质的量 B、t时间内生成C的物质的量
C、t时间内消耗B的物质的量浓度 D、t时间内消耗A的物质的量浓度
( )13、某反应过程中体系的能量变化如图所示,下列说法错误的是
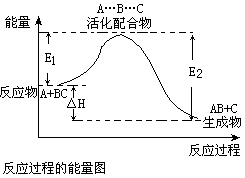 A、反应过程可表示为
A、反应过程可表示为
A+BC—→[A…B…C] —→AB+C
(反应物)(过渡态) (产物)
B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C、正反应的热效应为△H=E1—E2,且E2>E1,所以正反应为放热反应
D、此图中逆反应的热效应△H=E1—E2,为吸热反应
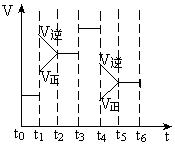 ( )14、反应N2(g)+3H2(g)
( )14、反应N2(g)+3H2(g)![]() 2NH3(g),△H<0,在某一时间段中反应速率与反应过程的曲线关系如图,则氨的百分含量最高的一段时间是
2NH3(g),△H<0,在某一时间段中反应速率与反应过程的曲线关系如图,则氨的百分含量最高的一段时间是
A、t0—t1 B、t2—t3
C、t3—t4 D、t5—t6
 ( )15、已知某可逆反应在密闭容器中进行,A(g)+2B(g)
( )15、已知某可逆反应在密闭容器中进行,A(g)+2B(g)![]() 3C(g)+D(s)(放热反应),曲线b代表一定条件下该反应的过程,若使曲线b为曲线a,可采取的措施是
3C(g)+D(s)(放热反应),曲线b代表一定条件下该反应的过程,若使曲线b为曲线a,可采取的措施是
A、增大A的浓度 B、缩小容器的体积
C、增大B的浓度 D、升高温度
( )16、反应2A(g) ![]() 2B(g)+E(g),正反应为吸热反应,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g),正反应为吸热反应,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减少E的浓度 D.降温
高一化学试题 (共8页) 第4页
( )17、已知1×105Pa298K在条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A 、H2O(g)=H2(g)+1/2O2(g)△H=242KJ·mol-1
B 、2H2(g)+O2= 2H2O(l) △H=-484KJ·mol-1
C 、H2(g)+ 1/2O2= H2O(g) △H=242KJ·mol-1
D、2 H2(g) +O2= H2O(g) △H=484KJ·mol-1
( )18、某化学反应其△H= —122 kJ·mol-1,∆S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
( )19、催化剂之所以能加快反应速率,是因为
A.减小了反应速率常数 B.降低了反应的活化能
C.降低了反应的焓 D.降低了反应的熵
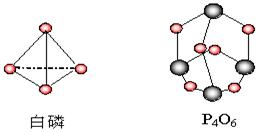 ( )20、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ•mol-1):
( )20、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ•mol-1):
P—P:198, P—O:360;
O==O:498。则反应:
P4(白磷)+ 3O2(g)=P4O6(s)的反应热△H为
A.-126 kJ•mol-1 B.+1638 kJ•mol-1 C.-1638 kJ•mol-1 D.+126 kJ•mol-1
 ( )21、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )21、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A 铅笔端作阳极,发生还原反应 B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生 D a点是负极,b点是正极
高一化学试题 (共8页) 第5页
高二化学试题
第Ⅱ卷(非选择题,共37分)
| 题 号 | 二 | 三 | 不规范 扣 分 | 总分 | |||
| 22 | 23 | 24 | 25 | 26 | |||
| 得 分 |
|
|
|
|
|
|
|

二、(本题包括2小题,共14分)
22、(7分)从H+、Na+、Cu2+、Cl-、SO42-五种离子中恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则采用的电解质为 。
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则采用的电解质为 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量减少,进行电解,采用的电解质为 。
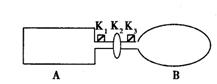 23、(7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2
23、(7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 ![]() N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率
αA将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡
高一化学试题 (共8页) 第6页
时,A中NO2的转化率将_________,B中NO2的转化率将_________(填:
变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。

三、(本题包括3小题,共23分)
24、(11分)实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪器名为______________________。
(2)两只烧杯间要填满碎纸条,其目的是________________________;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将____________(填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C =4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=________________。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量______________(填“相等”“不相等”),所求中和热______________(填“相等”“不相等”),简述理由__________________________________________________________________________________________________________________________
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会__________;若改用50mL 0.50 mol/L烧碱溶液进行上述实验,测得的中和热的数值会______________。(填“偏大”、“偏小”、“无影响”)
高一化学试题 (共8页) 第7页
25、(6分)向一定压的仪器中充入4LN2和H2的混合气体,反应后恢复到原温度, 体积变为3.4L,容器内气体对相同条件下H2的相对密度为5。
⑴反应达到平衡时V(NH3)= L,
反应前V(N2):V(H2)= ,N2的转化率为 。
⑵向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量。
①从开始到重新平衡,混合气体对H2的相对密度变化为 ;
A、先增大后变小 B、先减小后增大 C、一直减小 D、一直不变
②写出合成氨的热化学方程式:
26、(6分)在温度为373K时,把11.5g N2O4气体通入体积为500ml的真空密闭容器中立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
⑴开始时2s内以c(N2O4)的变化表示的反应速率是多少?
⑵达到平衡时体系内的压强是开始的多少倍?
高一化学试题 (共8页) 第8页
参考答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| D | C | C | C | C | B | A | D | C | B | A | C |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
|
|
| D | A | B | D | A | A | B | C | D |
|
|
|
22、(7分)⑴HCl;CuCl2;⑵Na2SO4;H2SO4;NaHSO4;⑶NaCl;CuSO4
23、(7分)(1)< 变小 (2)增大 不变 变小 (3)A (4)0.02mol
24、(11分)⑴搅拌器;⑵保温隔热,减少热量损失;⑶偏小;⑷= —16.72(t2—t1) KJ·mol-1
⑸不相等;相等;中和热是指稀溶液中酸与碱发生中和反应生成1mol水放出的热量与酸碱用量无关。⑹减少;减少。
25、(6分)⑴0.6L;1:3;30%;⑵①A;②N2(g)+3H2(g)![]() 2NH3(g)△H=—92kJ/mol
2NH3(g)△H=—92kJ/mol
26、(6分)解:(1)v(N2O4)=![]()
(2) ![]()