高二化学第一学期期终调研考试试卷
(必修)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间75分钟。
第Ⅰ卷(选择题 共69分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 O-16 Na-23 Al-27 S-32
一、单项选择题:每题的四个选项中,只有一个选项是符合要求的(本题17小题,每小题3分,共51分)
1.学习和研究化学是为了更好地认识世界。下列涉及的内容一般不属于化学研究范围的是
A.探究一种新材料的合成与用途 B.探究一种新微粒的组成与结构
C.探究一种新药品的结构与性质 D.探究一种新物质的运动规律
2.据报道,欧洲一科学小组发现了第112号元素的一种同位素,其质量数为227,其中子数为
A.112 B.115 C.227 D.339
3.下列化学用语书写错误的是
A.乙酸的分子式:C2H4O2 B.乙烯的结构简式:CH2=CH2
C.氨分子的电子式:![]() D.铝离子的结构示意图:
D.铝离子的结构示意图: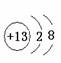
4.光导纤维的主要成分是
A.晶体硅 B.硅酸钠 C.二氧化硅 D.普通玻璃
5.下列元素中,属于第三周期IIA族元素的是
A.镁 B.铝 C.氧 D.硫
6.化学实验中的安全意识是重要的科学素质,下列实验操作或事故处理中,不正确的是
A.稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断搅拌
B.加热高锰酸钾制取氧气实验结束时,应先移去导气管,后熄灭酒精灯
C.皮肤上不慎沾上NaOH溶液,应立即用水洗涤,并涂上硼酸
D.钾钠着火时,应立即用砂子扑灭,切不能用水扑灭
7.下列反应中,HCl作还原剂的是
A.NaOH + HCl ==NaCl+H2O
![]() B.Zn + 2HCl ==ZnCl2 + H2 ↑
B.Zn + 2HCl ==ZnCl2 + H2 ↑
C.MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
D.CuO +2HCl ==CuCl2 + H2O
8.下列性质的比较,正确的是
A.酸性:H2SiO3 >H2CO3 B.碱性:Mg(OH)2 >Al(OH)3
C.稳定性:SiH4 >PH3 D.原子半径:N > C
9.下列离子在溶液中可以大量共存的一组是
A.H+、Na+、SiO32-、CO32- B.H+、Fe3+、NO3-、Cl-
C.Na+、Al3+、NH4+、OH- D.K+、Ba2+、SO42-、HCO3-
10.下列反应中,属于加成反应的是
A.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
B.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
|
D.![]()
11.下列实验操作正确的是
A.配制250 mL 2 mol / L NaOH溶液时应称量40 g NaOH
B.蒸馏时,温度计的水银球位于支管口附近
C.过滤操作中,为了加快过滤用玻璃棒在漏斗中搅拌
D.采用加热的方法除去碳酸氢钠固体中混有的碳酸钠
12.下列离子方程式中,错误的是
A.在CuSO4溶液中加入Ba(OH)2溶液:Ba2+ + SO42- == BaSO4↓
B.碳酸钙与盐酸反应:CaCO3+2H+==Ca2++CO2↑+H2O
C.铁与稀硫酸反应:Fe+2H+=Fe2++H2↑
D.氯化钠溶液与硝酸银溶液反应:Ag++Cl-=AgCl↓
13.在N2+3H2 ![]() 2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为
2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为
A.升高温度 B.增大H2的浓度 C.使用催化剂 D.增大压强
14.下列物质中含有共价键的离子化合物是
A.H2 B.NaCl C.NaOH D.H2S
15.将某病人的尿液加入新制的Cu(OH)2浊液中,微热时观察到红色沉淀,说明该尿液中含有
 A.醋酸 B.酒精
C.食盐
D.葡萄糖
A.醋酸 B.酒精
C.食盐
D.葡萄糖
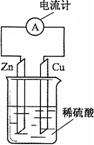
16.右图为铜锌原电池示意图,下列说法不正确的是
A.铜片上发生的反应为2H++2e-=H2↑
B.H+所得电子来自于金属铜
C.导线中电流的方向是由铜片到锌片
D.该装置将化学能转化为电能
17.下列说法正确的是(NA表示阿伏加德罗常数)
A.标准状况下,22.4L水所含电子数目为10NA
B.在常温常压下,11.2 L CH4含有的分子数为0.5NA
C.标准状况下,0.5 mol氯气含有的原子数为NA
D.常温常压下,11.2 L气体单质所含分子数均为NA
二、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本题6小题,每小题3分,共18分)。
阅读下面信息,回答18~19小题:
 2007年世界环境日主题为“冰川消融,后果堪忧”。
中国政府将“污染减排与环境友好型社会”(如右图)确定为今年世界环境日中国主题。
2007年世界环境日主题为“冰川消融,后果堪忧”。
中国政府将“污染减排与环境友好型社会”(如右图)确定为今年世界环境日中国主题。
18.在空气质量报告的各项指标中未被列出的物质是
A.二氧化硫 B.二氧化氮
C.二氧化碳 D.可吸入颗粒物
19.“保护环境,从我做起”。以下做法不利于环境保护的是
A.使用含磷洗涤剂洗衣服 B.用可降解塑料袋购物
C.将垃圾分类、回收 D.用天然气代替煤做燃料
20.为检验某一抗酸药的主要成分,某同学将该抗酸药研碎后分为两份,将其中一份溶于水滴加碘水,溶液变蓝色;另一份溶于酸,取上层清液逐滴加入加入NaOH溶液至过量,先产生白色沉淀,然后白色沉淀部分消失。由此判断该抗酸药中一定不含有
A.碳酸镁 B.氧化铁 C.氢氧化铝 D.淀粉
21.阿司匹林(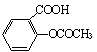 )学名叫乙酰水杨酸,下列说法错误的是
)学名叫乙酰水杨酸,下列说法错误的是
A.具有解热镇痛作用 B.大量服用可能造成中毒
C.可与氢氧化钠溶液反应 D.分子式为C8H4O4
22.下列做法正确的是
A.为了使火腿肠颜色更鲜红,多加一些亚硝酸钠做发色剂
B.为了使食品松脆可口,制造时添加碳酸氢钠做疏松剂
C.为了身体健康,应多饮用纯净水,少饮用矿泉水
D.为了补充足够的蛋白质,要多吃肉、少吃蔬菜和水果
23.黄瓜中含有丰富的维生素C(其结构简式为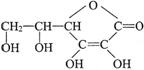 ),黄瓜在食用时一般采取生吃或加食醋凉拌,不易采用高温煎炒;将新鲜黄瓜汁滴入紫色石蕊试液,溶液颜色变红。下列说法不正确的是
),黄瓜在食用时一般采取生吃或加食醋凉拌,不易采用高温煎炒;将新鲜黄瓜汁滴入紫色石蕊试液,溶液颜色变红。下列说法不正确的是
A.维生素C在碱性条件下较稳定 B.维生素C在高温条件下不稳定
C.维生素C可以与Br2发生加成反应 D.维生素C可使高锰酸钾溶液褪色
第II卷(非选择题 共31分)
三、本大题包括2小题,共10 分。
24.(5分)食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
⑴碘是人体中不可缺少的 (选填“常量”或“微量”)元素;缺碘引起的疾病有 。
⑵已知在酸性溶液中IO3—可和I—发生反应:IO3—+5I—+6H+=3I2+3H2O,萃取碘水中的碘时,可选用的试剂是 ;根据上述反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中加入了碘酸钾。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是____________(选填数字代号)。
⑶已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题? 。
25.(5分) 蛋白质是生命的基础,没有蛋白质就没有生命。请回答下列问题:
⑴ 蛋白质分子中主要含有____________________四种元素。
⑵蛋白质是人体必需的营养物质之一,下列各类食物中,蛋白质含量最丰富的是 。

A. B. C. D.
⑶ 蛋白质在一定条件下能发生变性,从而失去生理活性。万一误服硫酸铜溶液,此时应立即作怎样的处理?_______________________。
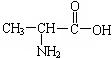
⑷一种二肽的结构简式为: ,合成这种二肽的氨基酸的结构简式是
、
。
,合成这种二肽的氨基酸的结构简式是
、
。
四、本大题包括3小题,共21分。
26.(5分)草木灰中含有KCl、K2CO3等钾盐,从草木灰中提取钾盐的实验步骤是:
称量![]() 溶解
溶解![]() 过滤
过滤![]() 蒸发浓缩
蒸发浓缩![]() 略去
略去
① ② ③ ④
回答下列问题:
⑴用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示(填下列正确选项的代码) 。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
⑵在进行第③步过滤操作时需要的玻璃仪器有:烧杯、 、 ;在进行第③步操作时,有时可能要重复进行,这是由于 。
⑶本实验中略去的实验步骤是 。
27.(6分)下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气。
 |
请回答以下问题:
⑴A的元素在元素周期表中位于 ,C的化学式是_______________。
⑵写出D与E反应转化为F和B的化学方程式_________________________________。
⑵在常温下,B的稀溶液也可与Cu反应,生成物之一为F,写出此反应的离子方程式: 。
28.(10分)某古铜色合金样品由三种金属元素组成,现取少量该样品进行实验,实验步骤与结果如下图所示。
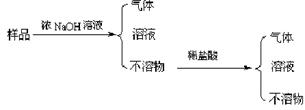 |
⑴假设每一步所加试剂均过量,由此可以推知:该合金中所含的金属元素是 。
A.Sn、Fe、Zn B.Al、Cu、Mg C.Al、Pb、Fe D.Mg、Ag、Cu
⑵进一步实验确认合金中Al元素的质量分数,取质量为10.0g的样品,加入足量浓NaOH溶液反应产生气体的体积为10.08L(折合成标准状况)。
求合金中铝元素的质量分数。
高二化学(必修)调研试题
参考答案及评分标准
一、单项选择题:每题的四个选项中,只有一个选项是符合要求的(本题17小题,每小题3分,共51分)
1.D 2.B 3.C 4.C 5.A 6.A 7.C 8.B 9.B 10.A
11.B 12.A 13.D 14.C 15.D 16.B 17.C
二、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(共6小题,每小题3分,共18分)。
18.C 19.A 20.B 21.D 22.B 23.A
三、本大题包括2小题,共10 分。
24.⑴微量 儿童个头矮小、智力低下;成人甲状腺肿大、大脖子病等 ⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
25.⑴ C、H、O、N ⑵ C ⑶ 服用大量蛋清、牛奶或豆浆减缓毒性
⑷
 (每空1分,共5分)
(每空1分,共5分)
四、本大题包括3小题,共21分。
26.⑴B ⑵玻璃棒 漏斗 滤液仍然混浊 ⑶冷却结晶(每空1分,共5分)
27.⑴第二周期、ⅣA族 CO2 ⑵3NO2 + H2O ===2HNO3 +NO
⑶3Cu +8H+ +2NO3- ===3Cu2+ +2NO↑ + 4H2O (方程式每空2分,其余每空1分,共6分)
28.⑴B (2分)
⑵2Al + 2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
54g 3×22.4L
m(Al) 10.08L
![]() =
=![]()
m(Al)==8.1g (3分)
w(Al)=![]() ×100%=81% (3分)
×100%=81% (3分)
答:合金中铝元素的质量分数为81%。