高三化学每周一练测试题(十)
可能用到的相对原子质量:H-1 C-12 N-14 O-16
一、选择题(每小题只有一个选项符合题意。每小题6分,共48分)
1.常见的晶体有如下类型:①分子晶体 ②离子晶体 ③原子晶体 ④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是( )
A、①②③④ B、只有①③④ C、只有①②③ D、只有①③
2.下列各组在溶液中反应,无论反应物的量怎么改变,其化学方程式都不变的是( )
A.FeBr2与Cl2 B.Ba (OH)2与H2SO4
C.CO2与NaOH D.Ca (HCO3)2与NaOH
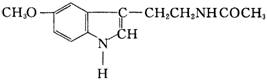 3. 脑白金,其有效成分的结构简式为
下列对该化
3. 脑白金,其有效成分的结构简式为
下列对该化
合物的叙述正确的是( )
A.它属于芳香烃 B.它属于高分子化合物
C.分子式为C13N2H18O2 D.在一定条件下可以发生加成反应
4. 在一定条件下,RO3n-与R2-发生如下反应: RO3n- +2R2- +6H+ =3R+3H2O,下列关于元素R的叙述中正确的是( )
A.R原子的最外层上有4个电子 B.RO3n-中的R只能被还原
C.HnRO3一定是强酸 D.R的单质既有氧化性又具有还原性
5. 下列离子方程式书写正确的是( )
A.碳酸钙溶于醋酸中 ![]()
B.金属钠投入水中
![]()
C.氢氧化亚铁溶于稀硝酸 ![]()
D.氯化铁溶液中加过量氨水 ![]()
6.下列各指定微粒数目比不是1:1的是( )
A.![]() 晶体中的阳离子和阴离子
晶体中的阳离子和阴离子
B.![]() 晶体中的钠离子和碳酸氢根离子
晶体中的钠离子和碳酸氢根离子
C.![]() 离子中的质子和中子
离子中的质子和中子
D.![]() 水溶液中的氢离子和氢氧根离子
水溶液中的氢离子和氢氧根离子
7.恒温、恒压下,1![]() A和
A和![]()
![]() B在一个容积可变的容器中发生如下反应:
B在一个容积可变的容器中发生如下反应:
![]() ,一段时间后达到平衡,生成
,一段时间后达到平衡,生成![]()
![]() C。则下列说法中正确的是( )
C。则下列说法中正确的是( )
A.物质A、B的转化率之比为1:2
B.起始时刻和达平衡后容器中的压强比为![]()
C.若起始时放入3![]() A和
A和![]()
![]() B,,则达平衡时生成3
B,,则达平衡时生成3![]()
![]() C
C
D.当![]() 时,可断定反应达到平衡
时,可断定反应达到平衡
8.仅含碳、氧两种元素的气体中,碳和氧的质量之比为3:5,则该气体可能是( )
①由CO或![]() 单独组成的纯净物 ②由CO和
单独组成的纯净物 ②由CO和![]() 共同组成的混合物
共同组成的混合物
③由CO和![]() 共同组成的混合物 ④由
共同组成的混合物 ④由![]() 和
和![]() 共同组成的混合物
共同组成的混合物
A、①② B、②③ C、③④ D、②④
二、(共52分)
9.(10分)意大利科学家使用普通氧分子和带正电荷的氧离子作用,制出了新型的氧分子![]() ,它具有很强的氧化性;它的结构很复杂,可能具有与
,它具有很强的氧化性;它的结构很复杂,可能具有与![]() 相似的长方形结构。
相似的长方形结构。
(1)下列有关![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 分子内存在极性共价键
分子内存在极性共价键
B.合成![]() 的反应可看作核聚变反应,即不属于化学变化
的反应可看作核聚变反应,即不属于化学变化
C.![]() 与
与![]() 、
、![]() 都互为同素异形体
都互为同素异形体
D.![]() 将来可用作更强有力的火箭推进的氧化剂
将来可用作更强有力的火箭推进的氧化剂
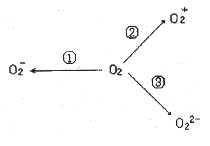 (2)制备含
(2)制备含![]() 、
、![]() 甚至
甚至![]() 的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
上述三个反应中, (填序号)相当于氧分子被氧化; (填序号)相当于氧分子被还原。
(3)写出![]() 的电子式:
的电子式:
(4)写出一种含有![]() 的化合物的化学式:
的化合物的化学式:
10.(16分)有A、B、C、D四种短周期元素,A、B、C为同一周期相邻三种元素。A和C的原子序数之比为3:4,A、B、C分别与D形成的化合物的电子总数相等。试回答:
(1)由四种元素中的两种元素组成的X、Y、Z三种多原子分子,已知X分子的空间构型为三角锥形,Y、Z分子空间构型为直线形,则X属于 分子(填“极性”或“非极性”),
Y、Z的结构式分别为 、 。
(2)写出实验室制取X的化学方程式 。
(3)由四种元素中的三种元素组成的化合物属于盐类,且其水溶液显酸性,则其化学式
为 ,其水溶液呈酸性的原因是 (用离子方程式表示)
(4)有人建议将元素D排在周期表的ⅦA族。下列事实能支持这一观点的是( )(填字母)。 ①H原子得到一个电子就达到稳定结构; ②氢分子的结构式为H—H;
③与碱金属元素形成离子化合物![]() ;④分子中原子间的化学键都属于非极性键。
;④分子中原子间的化学键都属于非极性键。
A、只有①②③ B、只有①③④ C、只有②③④ D、只有①②③④
(5)常温常压下,已知9![]() A的单质在氧气中完全燃烧生成稳定的氧化物时放出的热量为
A的单质在氧气中完全燃烧生成稳定的氧化物时放出的热量为
295KJ。则其燃烧的热化学方程式为 。
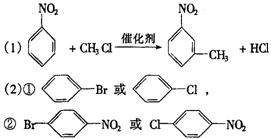
11.(11分)已知:①R— —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响.
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②_______________________________。
(3)B在苯环上的二氯代物有 种同分异构体。
(4)有机物 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
12. (15分) 已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此时容器的体积为V L,发生反应2A(g)+B(g) ![]() 2C(g),达平衡时,C的体积分数是0.4。
2C(g),达平衡时,C的体积分数是0.4。
(1)若恒温恒压时,开始充入4molC,达平衡时C的体积分数是 ,容器的体积为 L。
(2)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C的体积分数是0.4,压强为101kPa。则该容器的体积为 L。
(3)若控制温度为t℃,另选一容积不变的密闭容器,其体积为VL, 开始充入一定量的A和B,达到平衡时C的体积分数仍是0.4,则开始充入的A和B物质的量应满足 a<nA/nB<b,计算a、b是多少?
高三化学每周一练(十)参考答案
1.C 2. B 3.D 4.D 5.D 6. A 7. C 8. B
9.(10分)(1)C、D(2分) (2)2(2分) 1、3 (2分)
![]()
(3)
(2分) (4)![]() (2分)
(2分)
10.(16分)
(1)极性(2分),![]() (2分),
(2分),![]() (2分)。(两者可以互换)
(2分)。(两者可以互换)
(2)![]() (2分)
(2分)
(3)![]() (2分 )
(2分 )![]() (2分)
(2分)
(4)A(2分)
(5)![]() ;
;![]() 。(2分)
。(2分)
11. (11分)
(3)6
(4)不是 (方程式3分,其它每空2分)
12. (15分)
(1) 0.4 5V/3 (2) 5V/3 (每空3分)
(3)a=1/2 b=5 (6分)