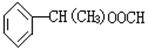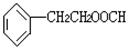北京市西城区2006年抽样测试高三化学试卷
YCY 本试卷分满分100分,考试时间120分钟。
可能用到的相对原子质量:H—1、C—12、N—14、O—16、Na—20、S—32、Ca—40
一、选择题(每小题只有一个正确选项,1—10小题,每题2分;11—18小题,每题3分。
共44分)
1.下列各组中的物质,互为同位素的是 ( )
A.白磷与红磷 B.苯与甲苯 C.重氢与超重氢 D.2—甲基丙烷与丁烷
2.血液属于胶体,透析是除去肾衰竭病人血液中的毒性物质,从而拯救病人生命的重要方
法。透析的原理是 ( )
A.蒸发 B.电泳 C.过滤 D.渗析
3.下列物质中,属于天然高分子化合物的是 ( )
A.脂肪 B.纤维素 C.氨基酸 D.蔗糖
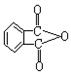
4.![]() C—NMR(核磁共振)可以用于含碳化合物的结构分析。下列有关
C—NMR(核磁共振)可以用于含碳化合物的结构分析。下列有关![]() C的说法不正确的
C的说法不正确的
是 ( )
A.核外有13个电子 B.核内有6个质子
|
5.在泡沫橡胶的制造中,要利用下面反应放出的氧气:2H2O2 2H2O+O2↑,该反应中的
双氧水 ( )
A.仅为氧化剂 B.仅为还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
6.某无色透明的强酸性溶液中,能大量共存的一组离子是 ( )
A.Mg2+、Al3+、SO42-、NO3- B.Na+、AlO2-、K+、SO22-
C.MnO4-、K+、SO42-、Na+ D.NH4+、NO3-、Fe2+、Cl-
7.下列说法中,正确的是 ( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定不含非极性键
D.由于水分子之间存在氢键,所以水分子比较稳定
8.下列有关实验内容的叙述正确的是 ( )
A.苯酚沾到皮肤上应立即用清水洗涤
B.用溴水可区分甲苯、苯、四氯化碳
C.乙醇中混有少量乙酸可用加入生石灰再蒸馏的方法提纯
D.银镜反应实验后附有银的试管可用稀H2SO4清洗
9.下列离子方程式正确的是 ( )
A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B.将Al条投入NaOH溶液中:Al+OH-+H2O=AlO2-+H2↑
C.向NaHSO4溶液中滴加Ba(OH)2溶液至恰好为中性:
|
D.电解饱和食盐水:2Cl-+2H2O H2↑+Cl2↑+2OH-
10.右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不
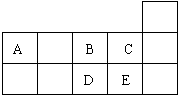 正确的是 ( )
正确的是 ( )
A.A与B形成的阴离子可能有:AB32-、A2B42-
B.E的氢化物的沸点比C的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB2
D.A与E形成的化合物是非极性分子
11.相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则
所得溶液的体积 ( )
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
12.木糖醇常用做口香糖的甜味剂。木糖醇的结构简式为
CH2OH—CHOH—CHOH—CHOH—CH2OH,下列有关木糖醇的说法不正确的是( )
A.是一种单糖 B.能发生酯化反应
C.不能发生水解反应 D.在口腔中不易被氧化
13.下列选项中所涉及到的两个量的一定相等的是 ( )
A.11.2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
14.用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液。一段时间后,溶液颜色
变浅。此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度应向电解后的溶液
中加入适量的 ( )
A.Na2SO4和CuSO4 B.CuO
C.Na2O和CuO D.H2O和CuSO4
15.据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换模燃料电池
(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催
化剂,导电离子是H+。下列对该燃料电池的描述中正确的是 ( )
|
③总的化学反应为:2H2+O2 2H2O ④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
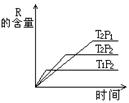
![]() 16.在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下面图像。下列叙述
16.在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下面图像。下列叙述
|
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是液体
D.正反应放热,L是气体
17.工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充
水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为 ( )
A.70.0% B.69.5% C.63.6% D.53.8%
18.取ag某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质
量增加了bg。若b>a,则A为 ( )
A.H2 B.CO C.C12H22O11 D.C6H12O6
二、(本题包括1小题,共8分)
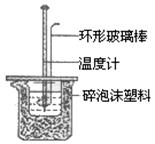
19.(8分)实验室用50mL 0.5mol/L盐酸、50mL 0.55mol/LNaOH溶液在下图所示装置进行
|
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
请回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是 ,
不能用铜丝搅拌棒代替环形玻璃棒的理由是 。
(2)经数据处理,t2-t1=3.4℃。则该实验测得的中和热△H= [盐酸和NaOH溶
液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与
△H的关系为:△H1 △H(填“<”、“>”或“=”),理由是
。
三、(本题包括3小题,共19分)
20.(5分)已知某溶液中只含有OH-、H-、Na+、CH3COO-四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是 。
(2)若溶液中c(CH6COO-)>c(H+)>c(H+)>c(OH-),则含有的溶质是
。
(3)若溶液是由体积相等的NaOH溶液和CH3COOH溶液混合而成, 恰好呈中性,则
混合前c(CH3COOH) c(NaOH)(填“<”“>”或“=”)。
21.(6分)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料
是偏二甲肼[(CH3)2N—NH2],氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是 ,产生该气体的化学反应方程式
为 。
(2)偏二甲肼在N2O4中燃烧的化学方程式为 ,
当有1mol偏二甲肼燃烧时,转移电子的物质的量为 。
22.(8分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X
或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元
素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。
试回答下列问题:
(1)A、B的元素符号分别为 、 。
(2)写出Y水解的离子方程式 。
(3)将9gB单质在空气中充分燃烧,所得气体通入1L 1mol/LNaOH溶液中,完全吸收
后,溶液中各离子浓度由大到小的顺序是 。
(4)在101kPa时,1gX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环
境无污染的稳定物质,放出18.6kJ的热量。该反应的热化学方程式为
。
四、(本题包括2小题,共17分)
23.(8分)化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐
患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。


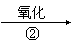
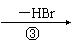
 (1)工业上用乙烯和氯气为原料经下列各步合成PVC:
(1)工业上用乙烯和氯气为原料经下列各步合成PVC:
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、③的化学方程
式分别为 、
。
|
( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为 。
|
试回答下列问题。
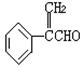
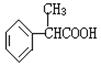
(1)X是一种重要的医药中间体,结构简式为 ,可能发生的
反应有 。
a.取代反应 b.消去反应 c.氧化反应 d.水解反应
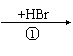 |  |  |
(2)有机物Y有如下转化关系:Y B C A
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氧化碳溶液褪色,
且苯环上只有一个取代基。
Y的结构简式为 或 。
(3)Z可由A经一步反应制得。
①Z的结构简式为 或 ;
|
分异构体有 、 、
、 。
五、(本题包括2小题,共12分)
25.(4分)某有机物R完全燃烧产物只有CO2和H2O。已知1mol R完全燃烧时,生成n molCO2,消耗1.5n molO2。试回答下列问题。
(1)若R为烃,则R的分子式为 。
(2)若R为烃的含氧衍生物,3.0g R与足量金属钠反应生成560 mL(标准状况)H2,则R的分子式为 。
26.(8分)某化工厂在硫黄矿为原料生产硫酸。若空气中氧气的体积分数按20%计算且不考虑各生产阶段的物质损失,回答下列问题。
![]() (1)已知2SO2(g)+O2(g) 2SO3(g),△H<0。生产中,为了提高SO2的转化率,
(1)已知2SO2(g)+O2(g) 2SO3(g),△H<0。生产中,为了提高SO2的转化率,
依据化学平衡原理所确定的条件或措施有 (填序号)。
a.原料在进入焚硫炉之前先粉碎 b.使用V2O5做催化剂
c.接触室中不使用很高的温度 d.用过量的空气跟SO2反应
e.接触氧化在常压下进行
(2)如果生产98%的硫酸10t,需要原料硫黄的质量为 t,需要消耗空气的体积(标准状况)为 m3。
(3)该厂每天消耗空气2.24×104m3(标准状况),生产98%的硫酸a t。若在SO2催化氧化时不再补充空气,并假设生产过程中硫酸的产率为100%,当硫燃烧后的混合气体中氧气的体积分数为b时,a= (用b表示),b的取值范围是
。
参考答案及评分标准
说明:其它正确答案可参照本标准给分。
一、选择题(1—10小题,每题2分;11—18小题,每题3分,共44分)
1.C 2.D 3.B 4.A 5.C 6.A 7.B 8.C 9.D 10.B 11.B 12.A 13.D 14.B 15.C 16.D 17.A 18.C
二、(本题包括1小题,共8分)
19.(1)上下搅动(或轻轻搅动)1分) Cu传热快,防止热量损失(2分)
(2)-56.8kJ/mol
(符号、热量数值均正确,给2分,有一处错误则不给分,答“-57.3”不给分)
(3)>(1分) NH3·H2O电离吸热(2分)
三、(本题包括3小题,共19分)
20.(1)CH3COONa(1分) (2)CH3COOH和CH3COONa(2分) (3)>(2分)
![]() 21.(1)NO2(1分) N2O4=2NO2(写“=”或“ ”号均可得分。共2分)
21.(1)NO2(1分) N2O4=2NO2(写“=”或“ ”号均可得分。共2分)
![]() (2)(CH3)2N—NH2+2N2O4 3N2+2CO2+4H2O
(2)(CH3)2N—NH2+2N2O4 3N2+2CO2+4H2O
(偏二甲肼写成C2N2H8或C2H8N2,“→”写成“=”号均可得分,不写条件及配平
错误扣1分。共2分)
16mol(1分)
22.(1)H(1分) C(1分)
![]() (2)NH4++H2O NH3·H2O+H+ (2分)
(2)NH4++H2O NH3·H2O+H+ (2分)
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (2分)
(4)4NH3(g)+3O2(g)=2N2(g)+6H2O(1); △H=-1264.8kJ/mol (2分)
![]() 四、(本题包括2小题,共17分)
四、(本题包括2小题,共17分)
23.(1)CH2=CHCl(2) CH2=CH2+Cl2 CH2ClCH2Cl (2分)
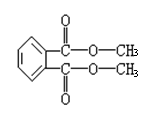
 nCH2=CHCl
[CH2CH]n (2分)
nCH2=CHCl
[CH2CH]n (2分)
(2) (2分)
|
|
(2) (1分) (1分)
| ||||
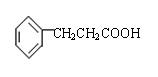 | ||||
(3)① (1分) (1分)
| ||||
| ||||
② (1分) (1分)
|
(1分)
五、(本题包括2小题,共12分)
25.(1)CnH2n (2分) (2)C3H8O (2分)
26.(1)c (1分) d(2分) (2)3.2t (1分) 1.68×104 (1分)
(3)a=20-100b (2分); 0.067≤b<0.2 (0.067写成1/15得分。共2分)