河北衡水中学2004—2005学年度第一学期第三次调研考试
高三年级化学试卷 命题人:董丽红
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共110分。考试时间110分钟。
第Ⅰ卷(选择题 共52分)
可能用到的原子量:C-12 H-1 O-16 N-14 Si-28 P-31 S-16 Cl-35.5 Na-23 Mg-24 Al-27 Fe-56 Cu-64 Ag-108 Zn-65
一、选择题(每小题2分,共52分。下列每小题所给选项只有一项符合题意,请将正确答案的序号填涂在答题卡上)
1.用化学方法不能实现的是
A.生成一种新分子 B.生成一种新离子
C.生成一种新核素 D.生成一种新单质
2. 下列电子式中书写正确的是

3. 下列物质中不会因见光而分解的是
A. NaHCO3 B. HNO3 C. AgI D.HClO
4.已知某溶液中存在较多的H+、SO42--、NO3--,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO--、Cl-- B.Mg2+、Ba2+、Br—
C.Fe2+、Cl--、I-- D. Na+、NH4+、Cl—
5.以NA表示阿弗加德罗常数,下列说法中正确的是 ( )
A.53g碳酸钠中含NA个CO32- B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子 D.标准状况下11.2L臭氧中含NA个氧原子
6.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验。其中合理、可靠的是
A. 观察常温下的状态。SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B. 测定SbCl3、SbCl5、SnCl4的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C. 将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论: SbCl3、SbCl5、SnCl4都是离子化合物
D. 测定SbCl3、SbCl5、SnCl4的水溶液,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
7.在以下电解池中,随着电解的进行,电解池中溶液的pH值会减小的是 ( )
A.铜为阳极、铜为阴极,电解液为CuSO4溶液
B.石墨为阳极、铁为阴极,电解液为CuSO4溶液
C.银为阳极,铜为阴极,电解液为AgNO3溶液
D.石墨为阳极,铁为阴极,电解液为NaCl溶液
8. 下列指定微粒的个数比为2:1的是
A. BaO2(过氧化钡)固体中的阴离子和阳离子 B. 12H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. Be2+离子中的质子和电子
9. 在10mL 0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH-) B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAc) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
10.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系是
A. m=n B. m>n C. m<n D. 无法判断
11. 密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积水稀释后,所得溶液的质量分数为
A. 等于12.5% B. 小于12.5% C. 大于12.5% D. 无法确定
12. 下列有关碱金属铷(Rb)的叙述中,正确的是
A. 灼烧氯化铷时,火焰有特殊颜色 B. 硝酸铷是共价化合物,易溶于水
C. 在钠 钾 铷三种单质中,铷的熔点最高 D. 氢氧化铷是弱碱
13. 下列分离或提纯物质的方法错误的是
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
14. 把铁棒和锌棒用导线连接插入硫酸铜溶液中,当电路中有0.2mol电子通过时,
负极的质量变化是( )
A. 增加6.5克 B. 减少6.5克 C. 减少5.6克 D. 增加6.4克。
15. 为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A. Na2SO3溶液(BaCl2) B. FeCl2溶液(KSCN)
C. HCHO溶液(石蕊试液) D. Na2O2(BaCl2溶液)
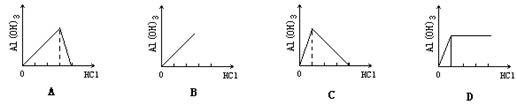
16.如图,向NaAlO2溶液中滴入盐酸,生成Al(OH)3沉淀的曲线正确的是( )
17.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用.下列关于NO的说法不正确的是
A. NO分子中有极性共价键 B. NO是造成光化学烟雾的因素之一
C. NO是汽车尾气的有害成分之一 D. NO分所含电子总数为偶数
18.A,B,C三种溶液中各含有Fe3+,Cu2+,Ag+中的一种离子,向A溶液中加入适量的铁粉,有红色物质析出,再加入C溶液,红色物质溶解但无银白色物质析出,则A,B,C依次含有
A.Fe3+,Cu2+,Ag+ B.Cu2+,Ag+,Fe3+ C.Ag+ Fe3+,Cu2+ D.Fe3+,Ag+,Cu2+
19.下列离子方程式正确的是
A.铁跟FeCl3溶液反应:Fe+Fe3+=2Fe2+
B.Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.FeCl2溶液跟Cl2反应:Fe2++Cl2=Fe3++2Cl-
D.Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O
20. 将20g NaHCO3和NaOH的混合物在密闭容器中加热到500oC使其充分反应后排出气体,然后冷却至常温,称得其质量变为18.2g,则下列说法正确的是:
A.NaOH的物质的量比NaHCO3少 B. 排出的气体为CO2和水蒸气
C. NaOH的质量为4g D. NaHCO3的质量为8.4g
21.在密闭容器中,下列反应达到平衡后,缩小容器的容积,则容器中混合气体的平均式量不增加的是
A.N2+3H2
![]() 2NH3
B.2NO2
2NH3
B.2NO2
![]() N2O4
N2O4
C.H2+I2(气)
![]() 2HI D.2SO2+O2
2HI D.2SO2+O2
![]() 2SO3
2SO3
22.现有下列物质:①硫酸铜晶体;②固体碘化银;③溴水;④硫酸亚铁晶体;⑤高锰酸钾溶液;⑥铜单质.其颜色按“赤橙黄绿蓝紫”的顺序排列的是
A.⑥③①②④⑤ B.⑥③②①④⑤
C.⑥③②④①⑤ D.⑥②①④⑤③
23.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y, W可以形成自然界最硬的原子晶体。下列叙述错误的是
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
24.若在化学实验中出现下列事故,处理方法正确的是
A.金属钠着火,用泡沫灭火器扑灭
B.苯酚沾在手上,立即用NaOH溶液清洗
C.皮肤上粘上浓H2SO4,马上用大量水冲洗
D.酒精灯在桌上歪倒着火,立即用湿布盖灭
25. 向一种溶液中滴加另一种溶液后,溶液的颜色不发生明显变化的是
A.钠与水反应后的溶液中滴加酚酞
B.硫酸铁溶液中滴加苯酚溶液
C.碘水中滴加碘化钾溶液
 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
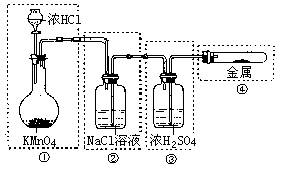
26. 已知KMnO4与浓HCl在常温下反应能产生Cl2。
若用如图所示的实验装置来制备纯净、干燥的氯
气,并试验它与金属的反应。每个虚线框表示一
个单元装置,其中有错误的是
A.只有①和②处 B.只有②处
C. 只有②和③处 D.只有②、③、④处
Ⅱ卷(共58分)
二、填空与简答
27.(3分) 在25℃、101KPa 下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,请写出甲醇燃烧的热化学方程式_______________________________
28.(3分)已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-离子参加反应时共转移0.4mol电子,请填空:(1)反应的氧化产物为______。 (2)x=______。
(3)参加反应的氢离子的物质的量为______。
29. (9分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
30.(3分)牙齿的损坏实际是牙釉质[Ca5(PO4)3OH]溶解的结果。在口腔中存在着如下平衡:
![]() [Ca5(PO4)3OH] 5 Ca2+
+ 3PO43-- + OH--
[Ca5(PO4)3OH] 5 Ca2+
+ 3PO43-- + OH--
当糖附着在牙齿上发酵时,会产生H+,试运用化学平衡理论说明经常吃甜食对牙齿的影响.
_____________________________________________________________________________
_________________________________________________________
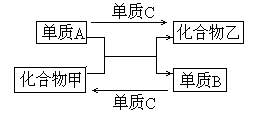 31. (6分)A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如右图所示关系.写出符合右图关系的A,B,C的化学式。((1)~(3)中的A不在同一主族.)
31. (6分)A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如右图所示关系.写出符合右图关系的A,B,C的化学式。((1)~(3)中的A不在同一主族.)
(1)若A是 ,则B为 ,C为 ;
(2)若A是 ,则B为 ,C为 ;
(3)若A是 ,则B为 ,C为 .
32. (18分)资料显示:"氨气可在纯氧中安静燃烧,产物均不是大气污染物……"。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
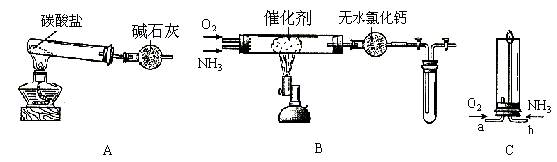
(1)实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
(2)本实验用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________;碱石灰的作用是_______________________________。
(3)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:①氨催化氧化的化学方程式是___________________________________________;试管内气体变为红棕色,写出此红棕色气体与水反应的离子方程式_________________________。②停止反应后,立即关闭B中两个活塞。将试管浸入冰水中,一段时间后,试管内气体颜色变浅,请用化学方程式来解释(标明产物颜色)______________________________________。
(4)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的顺序是先_____后______,其理由是_____________________________。
②氨气在纯氧中燃烧的化学方程式是_______________________________________________。
33.(8分)有钠、镁、铝各n mol,分别与等体积、均含xmolHCl的盐酸反应,指出下列情况下x的取值或取值范围:
(1) 钠生成的氢气最多:_____________________
(2) 钠、镁、铝生成的氢气一样多:______________________
(3) 生成的氢气钠<镁=铝:_____________________________
(4) 生成的氢气钠<镁<铝__________________________
三、计算
34. (8分)现取Cu与Fe2O3的混合物26.4g与1L 1mol/L的稀硫酸(过量)充分反应,没有固体剩余。(1)反应后测得溶液中Fe3+的浓度为0.05mol/L(溶液的体积仍为1L),则原固体混合物中Cu的质量是多少?反应后溶液中H+的物质的量浓度是多少?(不考虑盐类的水解)(要过程)
(2)若混合物中铜的物质的量分数为x,随x的变化,反应所消耗的硫酸的量也发生变化。要使固体完全溶解,且所消耗的硫酸的物质的量最少,x值应为________(直接写得数)
参考答案
如果您想得到答案,请免费注册成为我们的会员 英 才 化 学 网 www.ychxw.net