电解质溶液检测题
一、选择题(每小题只有一个选项符合题意,每小题3分)
1、下列物质属于强电解质且能导电的是:
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;(5)熔融NaOH;(6)稀硫酸;(7)苯甲酸;
A、(1)(2)(5)(6) B、(5)
C(2)(5) D、(1)(3)(4)(5)(6)
2、在一定温度下某酸溶液中水的电离度与某碱溶液中水的电离度相等,两溶液等体积混合后,混合液的pH:
A、大于7 B、小于7 C、等于7 D、无法确定
3、0.25mol/L H2SO4溶液10mL与0.5mol/L NaOH溶液10mL混合后,在加水稀释为100mL,各取少量分别加入有关指示剂,呈现颜色正确的是:
(1)甲基橙��黄色;(2)酚酞��红色;
(3)石蕊��红色;(4)酚酞��无色;
A、(1)(4) B、(1)(2)
C、(2)(3) D、(3)(4)
4、在一定温度下,在100mL某一元弱酸HA的溶液中,含有该弱酸的分子数为5.42×1020个,并测得该溶液的[H+]=10-3mol/L,在该平衡体系中,这种一元弱酸的电离度约为:
A、9% B、10% C、3% D、0.1%
5、向10mLpH=2的某酸溶液中加入10mLpH=12的NaOH溶液,充分反应后,滴入石蕊试液显红色,如果滴入甲基橙显黄色,则此酸一定是:
A、弱酸 B、多元弱酸 C、一元强碱 D、无法确定
二、选择题(每题有1~2个符合题意,每题3分)
6、氨水的下列性质中,可以证明它是弱电解质的是:
A、在相同的条件下,氨水的导电性比等物质的量浓度的一元碱溶液弱
B、氨水受热分解挥发出氨气
C、0.1mol/L氨水在常温下的pH值约为11
D、常温下氨水所能达到的最大浓度不如可溶性强碱
![]()
![]() 7、200C时,H2S的饱和溶液1L,其浓度约为0.1mol/L,其电离方程式为:H2S H++HS-,HS- H++S2-,若要使该溶液pH值增大的同时[S2-]减小,可采用的措施是:
7、200C时,H2S的饱和溶液1L,其浓度约为0.1mol/L,其电离方程式为:H2S H++HS-,HS- H++S2-,若要使该溶液pH值增大的同时[S2-]减小,可采用的措施是:
A、加入适量的水 B、加入适量的NaOH固体
C、通入适量的SO2 D、加入适量的CuSO4固体
8、某一元弱碱在浓度为1mol/L的溶液中电离度为0.001%,它的1mol/L的溶液导电能力最接近于:
A、1mol/LHNO3溶液
B、水自身电离出[H+]=10-9mol/L的盐酸
C、pH值为6的盐酸
D、1×10-3mol/L NaCl溶液
9、在下列溶液:(1)0.5mol/L的NaOH溶液和1.0mol/L的HCl溶液等体积混合后的溶液:(2)pH=0的溶液;(3)[OH-]=10-11mol/L的溶液;(4)0.1mol/L的CH3COOH溶液(α=1.32%),它们的酸性由强到弱的顺序是:
A、(2)>(1)>(4)>(3) B、(4)>(3)>(1)>(2)
C、(2)>(1)>(3)>(4) D、(1)>(2)>(4)>(3)
10、重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是:
A、中性溶液的pD=7.0
B、含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C、溶解0.01molDCl的D2O溶液1L,其pD=2.0
D、在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=1.0
![]() 11、能使H2O
H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是:
11、能使H2O
H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是:
A、将水加热到990C,使水pH=6 B、在水中滴入稀H2SO4
C、在水中加入小苏打 D、在水中加入氯化铜
12、已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是:
A、浓的强酸和稀的强碱溶液反应
B、浓的弱酸和稀的强碱溶液反应
C、等浓度的强酸和弱碱溶液反应
D、生成了一种强酸弱碱盐
13、在一定温度下,一定质量的Ba(OH)2饱和溶液中,加入少量的固体BaO,则下列说法正确的是:
A、溶液的pH值增大 B、溶液的pH值减小
C、溶液中的Ba2+总数减小 D、溶液中的Ba2+总数增加
14、某0.1mol/L的一元弱酸(用HA表示),未电离的弱酸分子(HA)的物质的量与电离生成的阴、阳离子总物质的量之比为4.5:1,则此溶液:
A、电离度α为10% B、α= 20%
C、pH=1 D、[OH-]=1×10-12mol/L
15、已知8%、7.16%、0.01%分别是同一条件下,同一浓度的三种酸溶液的电离度,若已知有如下反应:
NaCN+HNO2==HCN+NaNO2 NaCN+HF==HCN+NaF
NaNO2+HF==HNO2+NaF,在相同条件下,由此可判断得出的结论是:
A、HF的电离度为8% B、HNO2的电离度为0.01%
C、HCN的电离度为7.16%
D、HNO2电离度比HCN大,比HF小
16、某溶液100mL,室温时测得其pH等于1。下列叙述中不正确的是:
A、该溶液[H+]≥0.1mol/L
B、把该溶液稀释成1L后,pH≥2
C、把该溶液稀释成1L后,pH≤2
D、中和此溶液需0.1mol/L的NaOH溶液的体积≥100mL
17、下列各组离子,在指定的环境下能大量共存的是:
A、在pH=0溶液中:Na+、K+、MnO4-、Cl-
B、和Al反应能产生氢气的溶液:K+、NH4+、Cl-、S2O32-
C、中性溶液:Al3+、K+、SO42-、AlO2-
D、[H+]<[OH-]的溶液:Na+、K+、SO32-、S2-
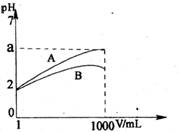
18、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如右图所示,则下列说法正确的是:
A、A、B两种酸溶液物质的量浓度一定相等
B、稀释后A酸溶液的酸性比B酸溶液强
C、a=5时,A是强酸,B是弱酸
D、若A、B都是弱酸,则5>a>2
19、室温下,某溶液中由水电离出来的H+和OH-浓度的乘积为10-24;在该溶液中,一定不能大量存在的离子是:
A、S2O32- B、NH4+ C、NO3- D、HCO3-
20、下列离子方程式中,正确的是:
A、在氯化铝溶液中加入过量的氨水:Al3++3OH-==Al(OH)3↓
B、在硫酸铜溶液中加入过量的氢氧化钡溶液:
Ba2++SO42-==BaSO4↓
C、在澄清石灰水中通入过量二氧化碳: OH-+CO2==HCO3-↓
D、在碳酸氢钙溶液中加入过量氢氧化钠溶液:
Ca2++HCO3-+OH-==CaCO3↓+H2O
三、选择题(每题只有1个项符合题意,每题4分)
21、将pH=8的Ba(OH)2溶液加水稀释1000倍,稀释后所得溶液中Ba2+浓度与OH--浓度之比为:
A、1:2 B、1:200 C、1:50 D、1:100
22、室温时pH=a的醋酸溶液与pH=b的氢氧化钠溶液等体积混合,恰好完全反应,则该溶液中醋酸的电离度可以表示为:
A、10(a+b-12)% B、10(a+b-14)% C、10(16-a-b)% D、10(14-a-b)%
23、在一定体积未知浓度的AgNO3溶液中,逐滴滴入pH=1的盐酸到恰好将溶液中的Ag+完全沉淀,测得反应后溶液的pH=2(反应过程中溶液的体积变化忽略不计),则AgNO3溶液的体积与盐酸的体积应符合:
A、9:1 B、10:1 C、1:9 D、1:10
24、向1L 0.1mol/L的醋酸溶液中加入0.3mol的冰醋酸(体积变化忽略),醋酸的电离度减小到原来的一半,则所得溶液中氢离子浓度是原溶液中氢离子浓度的:
A、1/2倍 B、2倍 C、1/4倍 D、4倍
25、PH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积混合,则溶液中[H+]为(mol/L):
A、1/5(4×10-9+1×10-12) B、1/5(8×10-9+1×10-12)
C、5×10-10 D、5×10-12
26、中和相同体积,相同pH值的Ba(OH2)、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则:
A、V3>V1=V2 B、V3>V2>V1
C、V1>V2>V3 D、V3<V1=V2
四、填空题:
27、在250C时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合前强酸的pH值与强碱pH之间应满足的关系是______________。
28、在250C时,有pH值为X的盐酸和pH值为Y的氢氧化钠溶液,取VX L盐酸同该氢氧化钠溶液中和,需VYL氢氧化钠溶液。问:
(1)若X+Y=14,则VX/VY=___________(填数值)
(2)若X+Y=13,则VX/VY=___________(填数值)
(3)若X+Y>14,则VX/VY=___________(填表达式),且VX_____VY(填>、<、=)且题中X≤6,Y≥8。
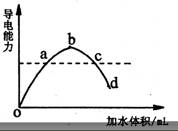 29、在一定温度下,冰醋酸加水稀释过程中,
29、在一定温度下,冰醋酸加水稀释过程中,
溶液的导电能力如右图所示;
请回答:
(1)a、b、c、d四点溶液pH值的大小顺序是___________。
(2)a、b、c、d四点醋酸的电离度最大的是___________。
(3)若使c点溶液中[CH3COO-]增大,溶液的pH值也增大,可加入的物质是(填写四类不同的物质)、___________、___________、___________、___________。
(4)若向c点溶液中加少量的冰醋酸,则醋酸的电离度___________;导电性___________;pH值___________。
(增增大、减小、不变)
![]() 30、近年来,某些自来水厂在用液氯进行消毒处理时还加入少量的液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氨胺),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌消毒时间的原因:_______________________________________________。
30、近年来,某些自来水厂在用液氯进行消毒处理时还加入少量的液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氨胺),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌消毒时间的原因:_______________________________________________。
31、已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……。今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
(1)HA+HC2-(少量)==A-+H2C-
(2)H2B(少量)+2A-==2B2-+2HA
(3)H2B(少量)+H2C-==HB-+H3C
回答下列问题:
(1)相同条件下HA、H2B、H3C三种酸中,酸性最强的是_________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子,最易结合质子(H+)的是___________,最难结合质子的是___________。
(3)判断下列离子方程式正确的是___________(填序号)。
A、H3C+3A-==3HA+C3-
B、HB-+A-==HA+B2-
(4)完成下列反应的离子方程式
A、H3C+__OH-(过量)=__________________。
B、HA(过量)+C3-=______________________。
五、计算题。
32、在50 mL 0.018mol/L的硝酸银溶液中加入50mL 0.02mol/L的盐酸,生成沉淀。若在溶液中[Ag+]和[Cl-]的乘积是一个常数,即[Ag+]·[Cl-]=1.0×10-10(mol/L) 2,求:
(1)沉淀完全后溶液的pH值;
(2)沉淀完全后,[Ag+]是多少?(体积变化忽略不计)
[参考答案]:
一、二、三选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| B | D | AD | B | A | AC | AC | B | A | CD | D | B | C |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| AD | AD | AB | D | CD | D | C | B | C | A | B | D | A |
四、填空题:
27、PH酸+PH碱=15;
28、(1)1 (2)0.1 (3)10X+Y-14, VX>VY
29、(1)d>a=c>b (2)d
(3) Na、Na2O、NaOH、Na2CO3;
(4)减小; 增加; 减小.
30、(1)氨胺比HClO稳定;(2)HClO以一氯胺形式储存起来;
(3)消耗HClO平衡向左移;
31、(1)H2B (2)C3-,HB-。(3)B(填序号)
(4)A、H3C+ 3 OH-(过量)==C3-+3H2O;
B、2 HA(过量)+C3-==H2C-+2A-;
五、计算题。
32、
(1)[H+]=![]() =0.01mol/L, pH=2;
=0.01mol/L, pH=2;
(2)[Cl-]==0.001,
[Ag+]=![]() =1.0×10-7mol/L。
=1.0×10-7mol/L。