2005—2006学年山东省潍坊市高三年级质量检测
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。全卷满分100分,考试时间90分钟。
第Ⅰ卷(选择题 共46分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有1个选项符合题意)
1.下列分散系中,分散质微粒直径最大的是txjy
A.雾 B.石灰乳 C.氢氧化铁胶体 D.淀粉溶液
2.据报道,科学家已成功合成了少量的O![]() (其结构式是
(其结构式是![]() ),有关O
),有关O![]() 的说法正确的是
的说法正确的是
A.O![]() 的摩尔质量是64 g
txjy
的摩尔质量是64 g
txjy
B.O![]() 与O
与O![]() 互为同位素txjy
互为同位素txjy
C.相同质量的O![]() 与O
与O![]() 所含原子个数之比为4∶3 txjy
所含原子个数之比为4∶3 txjy
D.O![]() 与O
与O![]() 、O
、O![]() 都是氧元素的同素异形体
都是氧元素的同素异形体
3.下列操作或试剂中,不可能使溴水变为无色的是
A.CCl![]() 多次萃取
B.镁粉
C.KOH溶液 D.KI溶液
多次萃取
B.镁粉
C.KOH溶液 D.KI溶液
4.在实验室进行下列有关物质的制备流程中,理论上正确、操作上可行且经济上合理的是
A. C![]() CO
CO![]() CO
CO![]()
![]() Na
Na![]() CO
CO![]()
B. Cu![]() Cu(NO
Cu(NO![]() )
)![]() 溶液
溶液![]() Cu(OH)
Cu(OH)
![]()
C. CaO![]() Ca(OH)
Ca(OH)![]() 溶液
溶液![]() NaOH溶液
NaOH溶液
D. Fe![]() Fe
Fe![]() O
O![]()
![]() Fe
Fe![]() (SO
(SO![]() )
)![]() 溶液
溶液
5.下列有关做法中一定不会引起爆炸的是
A.在面粉加工厂的车间内吸烟 B.光照氯气和甲烷混合气
C.点燃H![]() 和Cl
和Cl![]() 的混合气体
D. 室温时在空气中点燃纯净的甲烷
的混合气体
D. 室温时在空气中点燃纯净的甲烷
二、选择题(本题包括12小题,每小题3分,共36分,每小题只有1个选项符合题意)
6.丙烷的二氯取代物的同分异构体有
A.3种 B.4种 C.5种 D.6种
7.已知乙烯和乙炔燃烧的热化学方程式分别为:
2C![]() H
H![]() (g)+5O
(g)+5O![]() (g)=4CO
(g)=4CO![]() (g)+2H
(g)+2H![]() O(1);ΔH=-2600 kJ·mol
O(1);ΔH=-2600 kJ·mol![]()
C![]() H
H![]() (g)+3O
(g)+3O![]() (g)=2CO
(g)=2CO![]() (g)+2H
(g)+2H![]() O(1); ΔH=-1411
kJ·mol
O(1); ΔH=-1411
kJ·mol![]()
又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411kJ
8.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS)。已知羰基硫分子中所有原子均满足八电子结构,下列有关说法正确的是
A.羰基硫的电子式为![]() B.羰基硫属于非极性分子
B.羰基硫属于非极性分子
C.羰基硫中三个原子处于同一直线上
D.羰基硫沸点比CO![]() 低
低
9.在容积为2 L的密闭容器中,发生如下可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),经过5 min达到平衡,此时A减少a mol·L
pC(g)+qD(g),经过5 min达到平衡,此时A减少a mol·L![]() ,B的平均反应速率为
,B的平均反应速率为![]() ·mol·L
·mol·L![]() ,C增加
,C增加![]() mol·L
mol·L![]() ,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为
,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为
A.3∶1∶2∶2 B.1∶3∶2∶2 C.1∶3∶2∶1 D. 1∶1∶1∶1
10.设N![]() 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A.0.5 LpH=1的H![]() SO
SO![]() 溶液中含0.1 N
溶液中含0.1 N![]() 个H
个H![]()
B.1 molNa![]() O
O![]() 与足量水充分反应,转移的电子数为2N
与足量水充分反应,转移的电子数为2N![]()
C.以铝、稀H![]() SO
SO![]() 、NaOH溶液制备Al(OH)
、NaOH溶液制备Al(OH)![]() ,若消耗amolH
,若消耗amolH![]() ,则至少需消耗OH
,则至少需消耗OH![]() 的数目为aN
的数目为aN![]()
D.在20℃,1.01×10![]() Pa时,2.8gC
Pa时,2.8gC![]() H
H![]() 和CO的混合气体,含气体分子数小于0.1N
和CO的混合气体,含气体分子数小于0.1N![]()
11.下列反应的离子方程式书写正确的是
A.烧碱溶液和过量Ca(HCO![]() )
)![]() 溶液反应Ca
溶液反应Ca![]() +2OH
+2OH![]() +2HCO
+2HCO![]() =CaCO
=CaCO![]() ↓+CO
↓+CO![]() +2H
+2H![]() O
O
B.偏铝酸钠水解:AlO![]() 2H
2H![]() O
O![]() Al(OH)
Al(OH)![]() +H
+H![]()
C.硫酸铝溶液中加入过量氨水Al![]() +3NH
+3NH![]() ·H
·H![]() O=Al(OH)
O=Al(OH)![]() ↓+3NH
↓+3NH![]()
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe![]() +2H
+2H![]() +2H
+2H![]() O=Fe
O=Fe![]() +2H
+2H![]() O
O
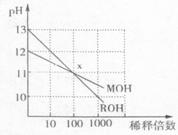 12.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
12.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M![]() )=c(R
)=c(R![]() )
)
D.稀释前,c(ROH)=10c(MOH)
13.影响分子晶体熔沸点时的因素主要是分子间的各种作用力。硝基苯酚的分子内和分子之间都存在氢键,邻硝基苯酚以分子内氢键为主,对硝基苯酚以分子间氢键为主,则邻硝基苯酚和对硝基苯酚的沸点比较正确的是
A.邻硝基苯酚高于对硝基苯酚 B. 邻硝基苯酚低于对硝基苯酚
C. 邻硝基苯酚等于对硝基苯酚 D. 无法比较
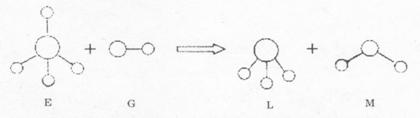 |
14.已知结构为正四面体型的离子E和直线型离子G反应,生成三角锥分子L和V形分子M(组成E、G、L、M微粒的元素原子序数均小于10),反应过程用下图表示,则下列判断错误的是
A.E、G、L、M都是10e![]() 微粒
B.L、M都是极性分子
微粒
B.L、M都是极性分子
C.L能使紫色石蕊试液变蓝色 D.E离子中,质子数一定大于中子数
15.如图所示装置,两玻璃管中盛满滴有酚酞溶液的氯化钠饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S![]() 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S
后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S![]() ,接通S
,接通S![]() ,电流表的指
,电流表的指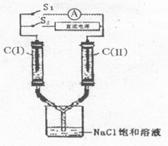 针发生偏转。此时有关该装置的说法错误的是
针发生偏转。此时有关该装置的说法错误的是
A.该装置为一原电池
B.C(Ⅰ)为原电池的负极
C.C(Ⅱ)的电极反应式是:Cl![]() +2e
+2e![]() =2Cl
=2Cl![]()
D.C(Ⅰ)附近溶液会进一步变红
16.2005年诺贝尔化学奖授予在“烯烃复分解反应”研究方面作出贡献的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如两分子烯烃RCH=CHR′用上述催化剂作用会生成两种新的烯烃RCH=CHR和R′CH=CHR′。则由CH![]() =CHCH
=CHCH![]() CH
CH![]() 和CH
和CH![]() =
=![]() 发生“烯烃复分解反应”,生成新烯烃种类为
发生“烯烃复分解反应”,生成新烯烃种类为
A.2种 B.3种 C.4种 D.5种
17.将足量的铜屑加入到浓度均为2 mol·L![]() 的HNO
的HNO![]() 和H
和H![]() SO
SO![]() 的混合溶液100 mL中,充分反应后,转移电子的物质的量为
的混合溶液100 mL中,充分反应后,转移电子的物质的量为
A.0.6 mol B.0.8 mol C.0.45 mol D.0.4 mol
第Ⅱ卷(非选择题 共54分)
三、(本题包括1小题,12分)
18.(12分)某化学实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(Ⅰ)制取氧化铜
(1)称取2 gCuSO![]() ·5H
·5H![]() O在_____________(填仪器)中研细后倒入烧杯,加10 mL蒸馏水溶解。
O在_____________(填仪器)中研细后倒入烧杯,加10 mL蒸馏水溶解。
(2)向上述CuSO![]() 溶液中逐滴加入NaOH溶液,立即产生蓝色沉淀,继续滴加,直到不再产生沉淀,然后将所得混合物转移到_________(填仪器)中,加热至沉淀全部变为黑色,停止加热。
溶液中逐滴加入NaOH溶液,立即产生蓝色沉淀,继续滴加,直到不再产生沉淀,然后将所得混合物转移到_________(填仪器)中,加热至沉淀全部变为黑色,停止加热。
(3)将步骤(2)所得混合物过滤、洗涤、晾干后研细备用。
回答下列问题:
① 完成上面的空白。
② 上述实验步骤中需要使用玻璃棒的是_________(填实验序号)。步骤(3)中洗涤沉淀的操作是_______________________________________。
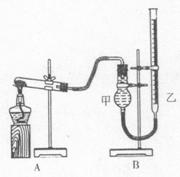 (Ⅱ)该小组同学从资料中得知氧化铜也能催化分解氯酸钾。他们为了比较氧化铜和二氧化锰的催化效果,设计用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已控制,相关数据见下表:
(Ⅱ)该小组同学从资料中得知氧化铜也能催化分解氯酸钾。他们为了比较氧化铜和二氧化锰的催化效果,设计用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已控制,相关数据见下表:
| 实验序号 | KClO | 其它物质质量 | 待测数据 |
| (4) | 1.2g | 无其他物质 | |
| (5) | 1.2g | CuO 0.5 g | |
| (6) | 1.2g | MnO |
回答下列问题:
①上述实验中的“待测数据”指_________________。
②若(5)(6)中待测数据分别为10和7(单位相同),则_________(填写化学式)催化效果好。
③为探究CuO在实验(5)中是否起催化作用,需补做如下实验(无需写出具体操作):a.__________________ ,b.验证CuO的化学性质没有改变。
四、(本题包括3小题,共30分)
19.(10分)A、B、C、D、E五种短周期元素,原子序数依次增大,已知B元素原子最外层电子数是次外层电子数的两倍,C可分别与A、D形成化合物A![]() C、A
C、A![]() C
C![]() 和D
和D![]() C、D
C、D![]() C
C![]() ;E的最外层电子数比最内层电子数多1。请回答:
;E的最外层电子数比最内层电子数多1。请回答:
(1)D![]() C
C![]() 的电子式_______________________。
的电子式_______________________。
(2)B与A_______________(填能或不能)形成与A![]() C
C![]() 电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
(3)请写出实验室制取B![]() A
A![]() 时反应的化学方程式_________________________
时反应的化学方程式_________________________
(4)E单质可与应用最为广泛的金属的最高价氧化物反应,并生成另一种化合物F,该反应化学方程式是______________________________________。
20.(10分)
(1)某温度时,水的离子积为K![]() =1×10
=1×10![]() ,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
(2)已知某溶液中只含有四种离子:A![]() 、B
、B![]() 、H
、H![]() 、OH
、OH![]() ,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A
,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A![]() 和B
和B![]() 组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
Na![]() 、Ag
、Ag![]() 、NH
、NH![]() 、Cl
、Cl![]() 、NO
、NO![]() 、CH
、CH![]() COO
COO![]() 、H
、H![]() 、OH
、OH![]()
①
c(B![]() )>c(A
)>c(A![]() )>c(H
)>c(H![]() )>c(OH
)>c(OH![]() ):______________________________。
):______________________________。
②
c(A![]() )>c(B
)>c(B![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() ):______________________________。
):______________________________。
③
c(H![]() )>c(B
)>c(B![]() )>c(A
)>c(A![]() )>c(OH
)>c(OH![]() ):___________________________________。
):___________________________________。
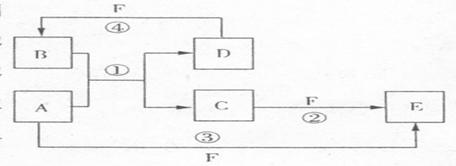 21.(10分)A、B、C、D、E、F六种物质的转化关系如右图所示(反应条件和部分产物未标出)。
21.(10分)A、B、C、D、E、F六种物质的转化关系如右图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓度液与A、D反应都有红棕色气体生成,则A的原子结构示意图为_________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是___________________,已知常温下1gD与F反应生成B(气态)时放出92.3 kJ热量,写出该反应的热化学方程式________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为__________________,B固体属于___________________晶体。
五、(本题包括1小题,12分)
22.(12分)向100 mL 3mol·L![]() 的NaOH溶液中缓慢通入一定量的CO
的NaOH溶液中缓慢通入一定量的CO![]() ,充分反应,测得最后溶液的pH>7。
,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________,如果是多种成分,可能是___________________________________。
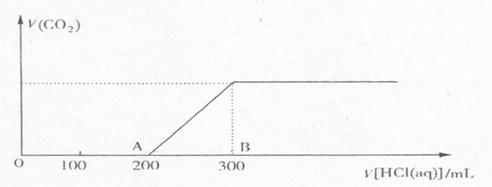 |
(2)在上述所得溶液中,逐滴缓慢滴加1mol·L
① 加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_____________。
② 产生的CO![]() 在标准状况下的体积为____________________mL。
在标准状况下的体积为____________________mL。
③ B点时,反应所得溶液中溶质的物质的量浓度是_______________mol·L![]() (溶液体积的变化忽略不计)。
(溶液体积的变化忽略不计)。
参考答案
1.B 2.D 3.D 4.C 5.D 6.B 7.A 8.C 9.A 10.C 11.C 12.D 13.B 14.D 15.D 16.C 17.C
18.(Ⅰ)①研钵;(2)蒸发皿 ②(1)(2)(3)
④ 在漏斗中加蒸馏水至刚好浸没沉淀,待溶液滤出后,重复该操作1—2次。
(Ⅱ)④生成25 mL气体所用的时间。
⑤
MnO![]()
⑥ 验证CuO的质量没有改变
19.(1)![]()
(2)能,C![]() H
H![]()
(3)CH![]() CH
CH![]() OH
OH![]() CH
CH![]() =CH
=CH![]() ↑+H
↑+H![]() O
O
(4)2Al+Fe![]() O
O![]()
![]() Al
Al![]() O
O![]() +2Fe
+2Fe
20.(1)10:1 c(Na![]() )>c(SO
)>c(SO![]() )>c(H
)>c(H![]() )=c(OH
)=c(OH![]() )(或:c(Na
)(或:c(Na![]() )=2c(SO
)=2c(SO![]() )>c(H
)>c(H![]() )=c(OH
)=c(OH![]() ))
))
(2)①NH![]() Cl(或AgNO
Cl(或AgNO![]() 或NH
或NH![]() NO
NO![]() )
)
②CH![]() COONa
COONa
③因为c(A![]() )+c(H
)+c(H![]() )>c(B
)>c(B![]() )+c(OH
)+c(OH![]() ),不遵循电荷守恒(其它合理解释同样给分)
),不遵循电荷守恒(其它合理解释同样给分)
21.(1) C+4HNO
C+4HNO![]() (浓)
(浓)![]() CO
CO![]() ↑+4NO
↑+4NO![]() ↑+2H
↑+2H![]() O
O
(2)2Fe![]() +Cl
+Cl![]() =2Fe
=2Fe![]() +2Cl
+2Cl![]()
H![]() (g)+Cl
(g)+Cl![]() (g)=2HCl(g);ΔH=-184.6kJ·mol
(g)=2HCl(g);ΔH=-184.6kJ·mol![]()
(3)2C+SiO![]()
![]() 2CO↑+Si 原子
2CO↑+Si 原子
22.(1)Na![]() CO
CO![]() 或NaHCO
或NaHCO![]() ;NaOH和Na
;NaOH和Na![]() CO
CO![]() Na
Na![]() CO
CO![]() 和NaHCO
和NaHCO![]()
(2)①OH![]() +H
+H![]() =H
=H![]() O CO
O CO![]() +H
+H![]() =HCO
=HCO![]()
②2240 ③0.75