2005年10月南京市部分名校高三联考
化 学 试 卷
YCY
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Ag 108 Ba 137
第Ⅰ卷(选择题,共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
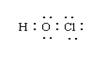 1.下列化学用语表示错误的是 ( )
1.下列化学用语表示错误的是 ( )
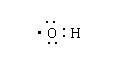
A.次氯酸电子式 B.羟基电子式
![]()
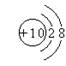
C.镁离子结构示意图 D.氨分子结构
2.在下列各说法中,正确的是 ( )
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
3.为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H++2I-==NO+I2+H2O 制得,NO在
制碘过程中的作用是 ( )
A.还原剂 B.氧化剂 C.催化剂 D.反应物
4.实验室制取下列气体,其反应放热的是 ( )
A.由电石制C2H2 B.由乙醇制C2H4
C.碳酸钠水解 D.由氯酸钾制O2
5.亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+离子转化为Fe3+离子,生成高铁血红蛋白
而丧失与氧气结合的能力,误食亚硝酸钠中毒,可服维生素C缓解.下列叙述中表现亚
硝酸钠和维生素C的性质正确的是 ( )
A.氧化性和还原性 B.还原性和氧化性
C.氧化性和酸性 D.还原性和碱性
6.巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3C00—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
7.下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
8.试管装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和
水的界面附近上下往复运动,下列说法不正确的是 ( )
A.此碱金属可能是钾或钠
B.反应一段时间煤油会燃烧
C.碱金属上下运动是由于与水反应产生了氢气
D.若是金属锂则不能观察到上述现象
二、选择题(本题包括10小题,第9 ~ 16小题每小题4分,第17、18小题每小题5分,共2分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其
化合物的叙述中,正确的是 ( )
A.LiOH加热时,不会分解 B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2 D.Li与稀硫酸反应生成Li2SO4
10.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是 ( )
 A.CuO→Cu2+- B.HNO3→NO C.Mg→Mg2+ D.Na2O2→O2
A.CuO→Cu2+- B.HNO3→NO C.Mg→Mg2+ D.Na2O2→O2
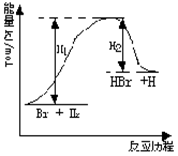
![]() 11.参照反应Br + H2 HBr +H的能量对反应历程的示
11.参照反应Br + H2 HBr +H的能量对反应历程的示
意图,下列叙述中正确的( )
A. 正反应为吸热的
B. 加入催化剂,该化学反应的反应热不变
C. 正反应为放热的
D. 加入催化剂可增大正反应速率,降低逆反应速率
12.将铝条投到一溶液中产生氢气,则此溶液中一定能够
大量共存的离子组是( )
A.Cu2+、Cl-、NO3-、K+ B.HCO3-、K+、SO42-、Cl-
C.Fe2+、Cl-、Na+、NO3- D.Ba2+、Cl-、K+、NO3-
13.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A.2Na218O2 + 2H2O == 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl + 2H2O![]() NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O
14.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Zn2+、SO42- B.Na+、Ba2+、NO3-、OH![]() 、SO42-
、SO42-
C.MnO4-、K+、Cl-、H+、SO42- D.K+、NO3-、SO42-、OH-、Na+
15.下列离子反应方程式正确的是 ( )
A.将少量的金属钠投入到盐酸溶液中:2Na+2H+=2Na++H2↑
B.二氧化硫气体通入到过量Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.碳酸氢镁溶液中加入足量石灰水:
Mg2++2HCO3+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O
D.KHS的水解:HS-![]() H++S2-
H++S2-
16.下列物质中杂质(括号内为杂质),可用加热的方法除去的是 ( )
A.Na2O2(Na2O) B.NaHCO3(Na2CO3)
C.Na2O(Na2O2) D.Na2CO3(NaHCO3)
17.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是 ( )
A.稀盐酸 Na2CO3溶液 B.AlCl3溶液 NaAlO2溶液
C.Cu FeCl3溶液 D.浓氨水 AgNO3溶液
18.做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸稀溶液
洗涤马上可以复原,其离子方程式为:MnO4—+C2O42—+H+→CO2↑+Mn2++![]() 。关于此反应的叙述正确的是 ( )
。关于此反应的叙述正确的是 ( )
A.该反应的还原剂是C2O42— B.该反应右边方框内的产物是OH—
C.该反应电子转移总数是5e- D.配平该反应后,H+的系数是8
第Ⅱ卷(非选择题,共76分)
三、(本题包括2小题,共20分)
19.(4分)硫酸铜晶体结晶水含量测定的实验,包括研磨、加热、称量等操作步骤。其中判断硫酸铜晶体完全失水的定性实验现象是_________ ______________
___ ____,完成测定过程至少要进行 次称量操作。
20.(16分)高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
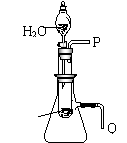 (1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第
二, 。
Na2O2跟水反应的离子方程式是
,其中还原剂是 ,
氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行
实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ,现象:
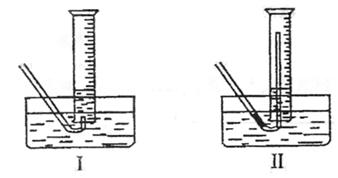
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用下图装置
中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)
|
 四、(本题包括2小题,共18分)
四、(本题包括2小题,共18分)
21.(8分)在化学反应中,只有极少数
能量比平均能量高得多的反应物分
子发生碰撞时才可能发生化学反应,
这些分子称为活化分子,使普通分
子变成活化分子所需提供的最低限
度的能量叫活化能,其单位通常用
kJ/mol表示。请认真观察右图,然
后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”
或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的
百分数增多,反应速率加快,你认为最可能的原因是_________________________。
22.(10分)热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为 0(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g); ΔH= 436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g);ΔH= - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g); ΔH= -185 kJ·mol-1
ΔH298(H2)= 436 kJ·mol-1 ,ΔH298(Cl2)= 247 kJ·mol-1
则ΔH298(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g); ΔH= -25 kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g); ΔH= - 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g); ΔH= 19 kJ·mol-1
请写出CO还原FeO的热化学方程式: 。
五、(本题包括2小题,共18分)
23.(10分)NaBH4是一种强还原剂。
(1)NaBH4极易溶于水,并与水剧烈反应放出H2,反应后硼以BO2—形式存在。写出反应的离子方程式:__________________________________________。实验表明,溶液酸性越强,生成H2的速度越快,其原因是__________________ _______
__________________ _________________________ _______
__________________ _______。
(2)在碱性条件下,NaBH4往往不是与水反应,而是与许多金属离子发生反应,硼仍以BO2—形式存在,例如冶金工业中,用NaBH4可使Au3+的废液中的Au3+还原。其离子方程式是_______________________________________________。
24.(8分)现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和NO2、O2的混合气体0.0270mol(不考虑N2O4)。请填空:
(1)混合气体中NO2的物质的量为______________mol.
(2)该反应中金属元素的化合价___________(填“升高”、“降低”、“不变”).
(3)写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目.
六、(本题包括2小题,共20分)
25.(8分)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO)
26.(12分) 将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入
1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)
(气体溶解忽略不计)。回答)
(1)原混合物中Na2CO3为 _______________g
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数
关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图
| V的取值范围 |
|
|
| |
|
| |
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | B | C | A | A | D | D | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AD | AB | D | B | AD | A | AD | BC | A |
二、非选择题
19.蓝色硫酸铜晶体完全变成白色粉末(2分) 4(2分)
20.(1)该反应是放热反应(1分);
2Na2O2+2H2O 4Na++4OH-+O2↑(2分);Na2O2(1分);Na2O2(1分)
(2)将带火星的木条靠近导管口P处,木条复燃(1分);将导管q浸入水中,反应过程中导管口有气泡冒出(2分)
(3)MnO2(2分);气泡迅速产生,能使带火星的木条复燃(1分)(只要合理均可给分)
(4)①Ⅱ(1分) 防止气体冷却时发生倒吸现象(2分) ②500mL(2分)
21.(1)放热 需要(各1分) -(E1-E2)kJ/mol(2分)
(2)409 kJ/mol(2分) (3)使用了催化剂(2分)
22.(1) 热能(2分); 小于(1分); 放热(1分)
(2)434 kJ·mol-1(3分)
(3)FeO(s)+CO(g)==Fe(s)+CO2(g); ΔH= -11 kJ·mol-1(3分)
23.(1)BH4—+2H2O===4H2↑+BO2— 从离子反应的角度看,NaBH4与H2O反应的实质是BH4—与H2O电离出的H+发生氧化还原反应。H+浓度越大,BH4—与H+反应的速率越快
(2)3 BH4—+8Au3++24OH-===3BO2—+8Au+18H2O
24.(1)0.024 (2分) (2)升高(2分)
|
(3)4Fe(NO3)2===2Fe2O3+8NO2↑+O2↑(方程式、电子转移各2分)
25.0.672L
26.(1)10.6g
| (2)V的取值范围 |
|
| V≤100mL |
|
| 100mL <V<500 mL | (0.001V-0.1)mol |
| V≥500 mL | 0.4 mol |
 n=f(V)
n=f(V) n=f(V)
n=f(V)