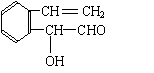2005年永州六中高三化学第二次模拟考试试题
本试卷分I卷和Ⅱ卷两部分。本卷考试时间:90分钟, 满分:100分。请考生注意一定把选择题答案写入答题卡中。可能用到的相对原子质量: H-1 C-12 O-16 N-14 K-39 Al-27 Cl-35.5
第Ⅰ卷 选择题 (48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有1个选项符合题意)
1.下列做法不利于改善环境的是
A.焚烧农作物秸秆 B.提倡使用农家肥
C.用H2作还原剂冶炼金属 D.限制燃油汽车数量的增加
2.下列离子化合物中阳离子半径和阴离子半径之比最大的是
A. LiI B.NaBr C. KCl D. CsF
3.将某溶液逐滴加入Fe(OH)3溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是
A.2 mol·L-1 HCl溶液 B.2 mol·L-1 NaOH溶液
C.2 mol·L-1 MgSO4溶液 D.硅酸溶液
4.下列除去杂质的方法正确的
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl气体:通入饱和Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
5. 已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是
A.LiOH加热时,不会分解 B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2 D.Li与稀硫酸反应生成Li2SO4
6. 1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是
A.该元素属于第七周期
B.该元素位于ⅢA族
C.该元素为金属元素.性质与82Pb相似
D.该同位素原子含有114个电子,184个中子
7.某无色透明的溶液,水电离出c(H+)=10-14 mol·L-1,在该溶液中一定能大量共存的是
A. Fe2+、K+、SO42-、NO3- B.Mg2+、NH4+、SO42-、Cl-
C. Na+、K+、SO42-、NO3- D.Ba2+、Na+、MnO4-、SO42-
8.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入了少量氢氧化钠溶液 HCO3- +OH-==CO32-+H2O
B.氯化铁溶液中通入硫化氢气体 2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入二氧化硫 Ca2++2ClO-+H2O+SO2==CaSO3↓+2HClO
D.氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-==3Fe3++2H2O+ NO↑
9. 设NA代表阿伏加德罗常数,下列说法正确的是
A.2.7g金属铝变为铝离子时失去了电子数目为0.3NA
B.在常温、常压下,11.2L N2含有分子数为0.5NA
C.在常温、常压下,l mol 氖气含有的原子数为2NA
D.在同温、同压下,相同体积中的任何气体单质所含的原子数一定相同
10. 在相同状况下,对于质量相同的H2、D2、T2:①密度之比为 l :2 :3 ;②质子数之比为
6 :3 :2 ;③中子数之比为0 :3 :4 ;④体积之比为6 :3 :2。下列叙述正确的是
A. 都正确 B.①② C.①②③ D.①③④
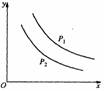 11. 反应L(s)+aG(g)
11. 反应L(s)+aG(g)![]() bR(g)达到平衡时,温度和压强对
bR(g)达到平衡时,温度和压强对
该反应的影响如左图所示。左图中:压强P1>P2,x轴表示温度,y
轴表示平衡混合气中G的体积分数。据此可判断
①上述反应是放热反应;②上述反应是吸热反应;
③ a>b;④a<b。
A.①③ B.①④ C.②③ D.②④
12.在25℃时,0.lmol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)恒等于 10-8 mol·L-1,下列叙述正确的是
A.溶液中水电离出的 c(OH-)=10-10 mol·L-1
B.溶液中 c(HA)+c(H+)=0.1mol·L-1
C.与 0.lmol·L-1 NaOH溶液等体积混合所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均减少
13. 对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
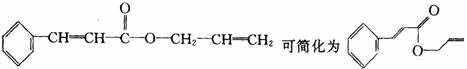
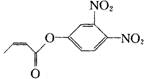 杀虫剂“阿乐丹”的结构表示如右式:若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是
杀虫剂“阿乐丹”的结构表示如右式:若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是
A.遇FeCl3溶液均显紫色
B.均能发生银镜反应
C.均能与溴水发生加成反应
D.均能与NaOH溶液发生反应
14.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A. 10% B. 15% C. 20% D. 25%
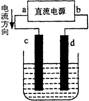
15.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
16.下列说法不正确的是
A.离子晶体中,一定存在离子键
B.阳离子只有氧化性,阴离子只有还原性
C.纳米粒子分散到水中,有丁达尔效应
D.氯碱工业中,阳离子交换膜是一种新型功能高分子材料
![]()
 一、选择题答题卡
一、选择题答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 非选择题 (满分52分)
17.(16分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题;
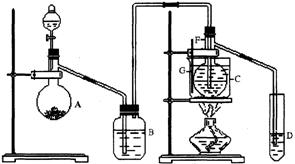
⑴实验开始时,仪器A中盛放电石,B中应装____________,其作用是
_______________________________。
⑵仪器D中盛放水,其作用_________________________________________________。
⑶蒸馏烧瓶 F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称_________________________________。将HgO加放F中的振作方法是___________________________________。
⑷装置图中,加热F的方法叫___________,所选用温度计G的量程表示正确的是______。(填代号)。
A. 0℃~50℃ B.0℃~100℃ C.0 ℃~200℃ D. 50 ℃~100 ℃ E. 0℃~360℃
⑸检验乙醛已制出的操作及现象是______ ___________________________________________________________。
18.(12分)下图中,A.C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是Al4C3(图中部分反应物或生成物没有列出)。
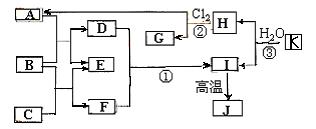
请按要求回答:
⑴ 写出B的化学式_______________,G的电子式_________________。
⑵ 反应①的离子方程式为_______________________________________。
⑶ 反应②进行的条件是_______________,反应的类型_____________。
⑷ 反应③的化学方程式为________________________________________。
19.(14分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
 |
(1)上述反应中,①是 反应,⑦是 反应。(填反应类别)
(2)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(3)写出D → F反应的化学方程式 。
![]() 20.(10分)含有C.H、O三种元素的芳香族化合物A,其苯环上有两个取代基,且位置相邻。A的相对分子质量不超过200,分子中氧的质量分数为19.75%,该物质可使溴的CCl4溶液褪色,可发生银镜反应,能与钠反应产生氢气,但不能与NaOH溶液反应。已知具有烯醇式(
)结构的物质不稳定。
20.(10分)含有C.H、O三种元素的芳香族化合物A,其苯环上有两个取代基,且位置相邻。A的相对分子质量不超过200,分子中氧的质量分数为19.75%,该物质可使溴的CCl4溶液褪色,可发生银镜反应,能与钠反应产生氢气,但不能与NaOH溶液反应。已知具有烯醇式(
)结构的物质不稳定。
请用中学化学知识回答:
(1)A的相对分子质量为______________,A的分子式为________________________。
(2)写出符合题意的A的结构简式(任写三种)
_________________________________________________________________________。
参考答案
一、选择题(48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | D | A | C | D | B | C | D | A | A | D | B | D | D | C | B |
17.(12分)(每空均2分)
(1) NaOH溶液, 除去由A装置导出的气流中混有的H2S
(2) 吸收乙醛蒸气
(3)氧化汞→水→浓硫酸; 将蒸馏烧瓶横置, 用药匙或纸槽将粉末送至底部, 再慢慢竖立即可
(4)水浴加热 B
(5)取D中少量溶液, 加入新制氢氧化铜悬浊液加热若产生红色沉淀即可证明乙醛已生成。
18.(12分,每空均2分)
⑴ Al 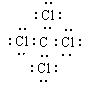 ⑵ Al3+ + 3AlO2— + 6H2O == 4Al(OH)3↓
⑵ Al3+ + 3AlO2— + 6H2O == 4Al(OH)3↓
⑶ 光照,过量Cl2 取代反应 ⑷ Al4C3 +12H2O == 4Al(OH)3 + 3CH4↑
19.(14分,每空均2分)
(1)加成反应,酯化反应;
![]()
 (2)
(2)
C: D:
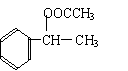 | |||
E: H:
![]()
(3)
20.(10分)
(1)162 , C10H10O2(各2分,共4分)
(2)任写以下三种(各2分,共6分)
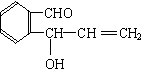 | |||
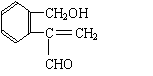 | |||||
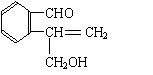 | |||||