无锡市2005年秋学期高中期末考试试卷
高三化学
注意事项:1、本试卷总分150分,考试时间120分钟
2、可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23
Mg:24 S:32 Cu:64 Br:80 Ba:137
3、请将选择题的正确答案填写在选择题的答案栏里
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,共32分。每小题只有1个选项符合题意)
1.“克隆”技术备受世界关注。“克隆羊”的关键技术之一是找到一些特殊的酶,这些酶能激活普通细胞使之像生殖细胞一样发育成个体。有关酶的叙述错误的是( )
A.酶是具有催化作用的蛋白质 B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能降低酶的活性 D.酶只有在强酸或强碱条件下才能发挥作用
2.下列解释不科学的是( )
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故
B.将煤气化为水煤气再使用的主要原因是减少其在燃烧过程中CO2的排放
C.严格地讲,实验室使用“通风橱” 防污染是不负责任的,因为实验产生的有害气体没有得到转化或吸收
D.“墙内开花墙外香”的微观原因是分子的不断运动
3.将氯气分别通入含有下列离子的溶液中,其中的离子不发生变化的是( )
A.Cu2+ B.Fe2+ C.HCO3- D.SO32-
4.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A.SiO2和SO2 B.NaOH和H2O2
C.CO2和H2O D.NaCl和HCl
5.把铝粉与下列氮的气态氧化物混合后,加热至高温,均可生成氮气和氧化铝。若反应后气体的压强是反应前气体压强的1/2(恒温恒容条件下测得),则氮的氧化物是( )。
A.NO B.N2O3 C.N2O D.N2O5
6.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是( )
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了I2O5等碘的氧化物
C.碘(I2)易溶于KI等碘化物溶液,形成I 3-离子
D.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子的离子化合物
7.下列物质中,长期露置于空气中会发生颜色变化的是( )
①绿矾 ②氢氧化亚铁 ③氯水 ④苯酚 ⑤亚硫酸钠 ⑥过氧化钠
A.全部 B.①②③④⑥ C.只有①②③ D.只有②③④
8.已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化:![]() ,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
A.X的氢氧化物是一种强碱 B.X的碳酸正盐不溶于水
C.X原子核外有6个电子层 D.X的最高化合价为+2价
二、选择题 (本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1mol CH3+ 所含的电子数目为6NA
B.72gC5H12中含有C−C键的数目一定为4NA
C.活泼金属与盐酸反应时,每放出1 mol H2,其电子转移的数目为2NA
D.常温常压下,22.4L NH3所含的电子数目为10NA
10.1mol 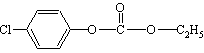 与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
A.3mol B.4mol C.5mol D.6mol
11.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg [c(H+)/c(OH-)] 。常温下,在AG=10的溶液中能大量共存的离子是( )
A、Cu2+、K+、Cl- 、SO42- B、NH4+、Fe3+、I一、SO42-
C、Fe2+、K+、NO3-、Cl- D、Na+ 、K+、ClO-、HCO3-
 12.2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
12.2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
A.MgB B.MgB2 C.Mg2B D.MgB6
13.工业生产苯乙烯是利用乙苯的脱氢反应:
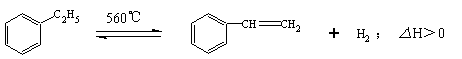
针对上述反应,有人提出如下观点,其中合理的是( )
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
14.能正确表示下列反应的离子方程式是( )
A.向偏铝酸钠溶液中滴加过量盐酸:AlO2-+4H+![]() Al3++2H2O
Al3++2H2O
B.用NaOH溶液吸收少量二氧化碳气体:OH-+CO2![]() HCO3-
HCO3-
C.向次氯酸钙溶液中通入少量二氧化硫:
Ca2++ClO-+SO2+H2O![]() CaSO3+2HClO
CaSO3+2HClO
D.向沸水中滴加少量饱和氯化铁溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
15.有一可逆反应 2A(g)+3B(g)![]() xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
(1)0. 8molA、1.2molB、1.2molC (2)1.4molA、2.1molB、0.6molC
达到平衡后,C的百分含量相等,则该化学方程式中x的值为( )
A.2 B.3 C.4 D.5
16.下列实验中,仪器的下端必须插入液面下的是( )
①制备氢气的简易装置中的长颈漏斗 ②制备氯气装置中的分液漏斗
③制备Fe(OH)2操作中的胶头滴管 ④将氯气溶于水时的导管
⑤用乙醇制取乙烯时的温度计 ⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
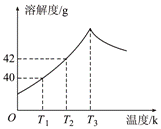 17.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为( )
17.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为( )
A.小于40g B.等于40g C.等于42g D.大于42g
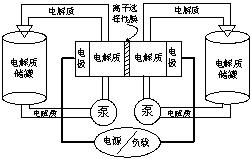 18. 下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是( )
18. 下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是( )
A.电池充电时,阳极电极反应式为:3Br-2e-=Br3-
B.电池放电时,负极电极反应式为:2S22-+2e-==S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3
D.在充电过程中Na+通过膜的流向为从左到右
选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题,共22分)
|
|
|
|
|
![]()
![]() ①
①
|
![]()
![]()
|
|
|
|
|
|
![]()
|
|
|
|
|
|
|
|
|
|
|
结论:CuSO4是锌与稀硫酸反应的催化剂
(2)现有三位同学分别利用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制取少量漂白粉,设计了三套实验装置:
|


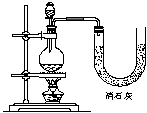
已知:温度稍高即发生如下副反应:6Cl2+6 Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O
(Ⅰ)请从:①不容易控制反应速率,②容易控制反应速率,③有副反应发生,④可防止副反应发生,⑤污染环境,⑥可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(Ⅱ)请从上述装置的A-G的组成中选取合理的部分组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是 。
20.(10分)为了测定空气中CO2的含量,可按如下步骤进行实验:
①分别配制100mL0.1mol·L-1和100mL0.01mol·L-1的标准盐酸;
②用0.1mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10mL,用去标准盐酸19.6mL;
③另取上述Ba(OH)2溶液10mL放入100mL的容量瓶中,加蒸馏水稀释至刻度,把稀释后溶液放入密闭容器中并导入10L(标准状况下)空气,充分振荡后过滤;
④取上述滤液20mL,用0.01mol·L-1的盐酸滴定,用去盐酸34.8mL。
根据上述实验回答下列问题:
(1)配制上述标准盐酸时,所需的玻璃仪器有:移液管(用于准确量取所需较浓盐酸的体积)、烧杯、 ;
(2)写出第③步的密闭容器中所发生反应的离子方程式:
;
(3)滴定过程中左手绝对不能离开活塞,右手拿住锥形瓶瓶颈并 ;眼睛应始终注视 ,
(4)若第②步滴定时使用过的酸式滴定管未经处理,立即更换溶液进行第④步滴定,会使实验结果 (填“偏高”、“偏低”或“无影响”);
(5)根据实验数据可以计算出空气中CO2的体积百分含量是 。
四、(本题包括2小题,共18分)
21.(8分)A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内中子数为零,B元素的原子最外层电子数是次外层电子数的3倍,C处于B的同一周期,且原子半径小于B,D与C是同主族元素,E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)画出B元素的原子结构示意图 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
(3)由E元素分别与C、D两元素组成的化合物溶于水形成等物质的量浓度的溶液,其溶液的pH由大到小的顺序是(用化学式表示) ;
(4)若1mol A单质与1mol D单质完全反应时共放出184.6kJ的热量,则该反应的热化学方程式为 。
|
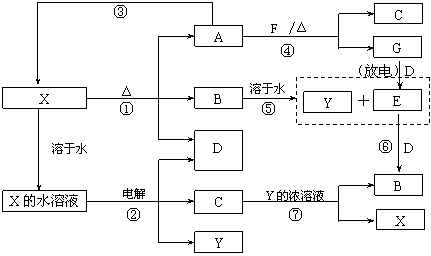 |
请回答下列问题:
(1)写出G分子的电子式: ;
(2)写出反应⑦的离子方程式是: ;
(3)写出电解X溶液的阳极反应式: ;
(4)写出反应④的化学方程式并标出电子转移情况:
;
![]() (5)若使F按下列途径完全转化为Y:
(5)若使F按下列途径完全转化为Y:
则参加反应的F与整个过程中消耗D的物质的量之比为 。
 五、(本题包括2小题,共18分)
五、(本题包括2小题,共18分)
23.(8分)某有机物A的结构简式为:
(1)某同学对其可能具有的化学性质进行了如下预测,其中错误的是 。
①可以使酸性高锰酸钾溶液褪色 ②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应 ④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应 ⑥遇FeCl3溶液可以发生显色反应
(2)该有机物的同分异构体甚多,其中有一类可以用
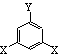 通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
, , , ;
24.(10分)下面是有名的Diels-Alder反应的一个实例:
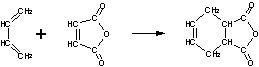
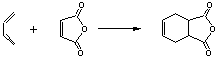 也可用下面相应的键线式表示:
也可用下面相应的键线式表示:
请认真分析上述变化,回答下列问题:
(1)写出下列反应产物的结构简式:
![]()
(2)以某链烃A为起始原料合成化合物X的路径如下(图中Mr表示相对分子质量):
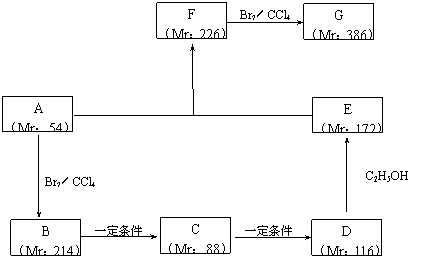 |
①指出反应类型:B→C : ,F→G : 。
②写出下列物质的结构简式:
A : ,F : 。
③写出下列反应的化学方程式:
B → C : ;
D → E : 。
六、(本题包括2小题,共18分)
25.(8分)有一瓶硫酸和硝酸的混合溶液,取出10mL该混合溶液,加入足量的氯化钡溶液充分反应后过滤、洗涤、烘干,可得到4.66g沉淀。滤液跟2.00mol·L-1NaOH溶液反应,共用去25mL碱液时恰好中和。求:
(1)混合溶液中H2SO4和HNO3的物质的量浓度。
(2)另取10mL原混合溶液,加入足量的铜粉共热,在标准状况下可收集到气体的体积。
26.(10分)将一定量的过氧化钠固体投到一定量的稀硫酸中,待完全反应后,在标准状况下共收集到3.36L的气体,然后将所得溶液蒸干得到不含结晶水的固体36.4g。通过计算回答下列问题:
(1)求过氧化钠固体的质量
(2)所得固体的组成和各组份的质量
(3)若加入过氧化钠固体的质量为m g,最后得到固体产物的质量为n g,则n的最大值为 (用含m的表达式表示),此时固体的成份是 。
无锡市2005年秋学期高中期末考试评分标准
高三化学
第Ⅰ卷(选择题 共74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | D | B | A | C | A | D | B | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BC | C | A | B | BD | AC | AD | C | A | AD |
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19.(12分)
(1)①④(4分,错选一个扣1分,错选二个扣3分,错选三个扣4分,本题不为负分)
| 优点 | 缺点 | |
| 甲装置 | ④ | ①⑤ |
| 乙装置 | ⑥ | ①③ |
| 丙装置 | ② | ③⑤ |
(Ⅰ)(每格1分)
(Ⅱ)F、B、E(2分)
20.(10分)(1)100mL容量瓶、胶头滴管、玻璃棒 (每个1分,共3分)
(2)Ba2++2OH-+CO2=BaCO3↓+2H2O (2分)
(3)摇动 锥形瓶内溶液的颜色 (各1分)
(4)偏高(1分) (5)0.02464%(2分)
四、(本题包括2小题,共18分)
21.(8分)(1)![]() (2分) (2)HF>HCl(2分) (3)NaF>NaCl (2分)
(2分) (2)HF>HCl(2分) (3)NaF>NaCl (2分)
(4)H2(g)+Cl2(g)=2HCl(g);ΔH=-184.6kJ·mol-1(2分)
22.(10分)(1)![]() (2分)
(2分)
(2)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
 (3)2H2O-4e-=4H++O2↑(2分)
(3)2H2O-4e-=4H++O2↑(2分)
(4) (2分) (5)1∶2(2分)
五、(本题包括2小题,共18分)
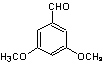
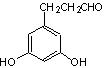
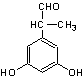
23.(8分)(1)(4分)④⑥(错选一个扣1分)
(2)(4分)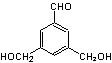
24.(10分)
(1)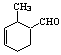 或 (2分)
或 (2分)
(2)①取代反应(或水解反应) 加成反应(各1分)
②X:CH2=CH-CH=CH2 F:![]() (扣1分)
(扣1分)
③B→C:CH2Br-CH=CH-CH2Br+H2O![]()
HOCH2-CH=CH-CH2OH+2HBr(2分)
D→E: HOOC-CH=CH-COOH+2C2H5OH![]()
C2H5OOC-CH=CH-COOC2H5+2H2O (2分)
六、(本题包括2小题,共18分)
25.(8分)(1)c(H2SO4)=2mol·L-1 c(HNO3)=1mol·L-1 (各2分)
(2)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
因为![]() ,所以H+过量,生成的气体体积应根据NO3-的量计算:(2分)
,所以H+过量,生成的气体体积应根据NO3-的量计算:(2分)
V(NO)=0.01mol×22.4L•mol-1=0.224L=224mL(2分)
26.(10分)
(1)23.4g (2分) (2)NaOH:8g Na2SO4:28.4g (各3分)
(3)![]() NaHSO4 (各1分)
NaHSO4 (各1分)