福建省莆田一中2007届高三化学第一次阶段性考试晶体的类型与性质单元测试
一.选择题(每题3分,共24分,每题只有一个符合要求的选项)
1.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是
A.I2 B.BaCO3 C.CO2 D.C6H12O6(葡萄糖)
2.下列说法中不正确的是
A.元素的种类由原子核内质子数决定
B.分子的种类由分子中原子间的化学键和分子的空间构型决定
C.核素的种类由原子核内质子数决定
D.晶体的种类由构成晶体的微粒及微粒间的作用力决定
3.下列叙述中正确的是:
A、任何固体物质都是晶体,具有一定的几何外形 B、离子晶体中不存在单个分子
C、极性分子才能形成分子晶体
D、离子晶体中可能含有共价键,分子晶体中一定含有共价键
4.在单质的晶体中一定不存在
A.共价键 B.阴、阳离子间的静电作用
C.分子间作用力 D.金属离子和自由电子间的作用
5.碘的熔点和沸点较低。其原因是
A.碘分子间作用力较弱 B.碘的氧化性较弱
 C.碘分子中I—I键不稳定
D.碘的非金属性较弱
C.碘分子中I—I键不稳定
D.碘的非金属性较弱
6.最近发现上种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图
所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为
A.TiC B.Ti4C7 C.Til3C14 D.Til4C13
7.下列物质按熔沸点由低到高的顺序排列的是
A、二氧化硅,氢氧化钠,萘 B、钠、钾、铯
C、干冰,氧化镁, 磷酸 D、C2H6,C(CH3)4,CH3(CH2)3CH3
8.下列叙述中,错误的是
A.离子化合物中可能存在共价键 B.原子晶体中一定存在共价键
C.分子晶体中一定存在共价键 D.含有离子键的化合物形成的晶体一定是离子晶体
二.选择题(每题3分,共24分,每题有1个或2个符合要求的选项)
9.关于氢键,下列说法正确的是
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.由于氨与水分子之间可形成分子间氢键,使氨在水中溶解度增大
D.H2O是一种非常稳定的化合物,这是由于氢键所致
10.AB型的化学式形成的晶体结构情况多种多样。下列图示的几种结构中最有可能是分子
晶体的是
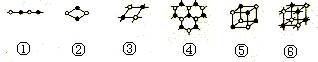
A.①③ B.②⑤ C.⑤⑥ D.③④⑤⑥
11.已知氢化锂固体不导电,隔绝空气熔融时能导电,它跟水反应能生成氢气。下列有关氢化锂的说法中,错误的是
A.LiH是离子晶体 B.LiH的水溶液呈酸性
 C.LiH是一种氧化剂 D.LiH中H—半径大于Li+半径
C.LiH是一种氧化剂 D.LiH中H—半径大于Li+半径
12.常见的离子晶体类型有五种,右图是其中的一种空间构型。
则该晶体的化学式可能为
A.YX4 B.YX2 C.YX D.XY2
13.最近科学家成功地合成了一种新型的化合物,该化合物晶体中,每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
A.该物质的化学式为CO4 B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O化学键之比为1:1
D.晶体的空间最小环共由12个原子所构成
14.在石墨晶体中,每一层有无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以
C—C键相结合。则石墨晶体中碳原子数与C—C键之比为
A.1:1 B.2:1 C.2:3 D.3:2
15.据报道,国外科学家用激光把装置于铁室中的石墨靶上的碳原子炸松,与此同时,再用射频电火花喷射氮气,此时碳原子结合成碳氮薄膜,据称此种化合物可能比金刚石还硬,其原因可能是
A、碳氮原子构成网状结构晶体 B、碳氮键比金刚石中的碳碳键更短
C、氮原子最外层电子数比碳原子多5 D、碳氮单质化学性质均不活泼
16.科学家发现铂的两种化合物:a为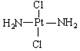 ,b为
,b为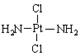 。两者有不同的特性,a比b易溶于水。则a与b的关系为
。两者有不同的特性,a比b易溶于水。则a与b的关系为
A.同分异构体 B.同素异形体 C.同位素 D.同种物质
三.填空题
17.(8分)有四种同族的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| 1 | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| 2 | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| 3 | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 4 | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题:
⑴ a为 色液体;b的分子式为: 。
⑵ 写出2系列中物质主要化学性质的递变规律(任写1种)__________________________
___________________________;能够说明该递变规律的化学事实是:
___________________________________________(任举1例,用离子方程式表示)。
⑶ 除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的
关系,该关系是______________________________________________________。
⑷ 上表中, 和 两种物质的沸点较同系列其它物质反常,反常的
主要原因是___________________________________________________
18.(10分)根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
⑴ 有下列仪器,本实验中需要的仪器是(填写字母)________________________________,除上述仪器外,还需要的仪器是(填仪器名称): ________________________________
A、带砝码的托盘天平 B、研钵 C、试管夹 D、酒精灯 E、蒸发皿
F、玻璃棒 G、坩埚 H、干燥管 I、石棉网 J、三角架
⑵ 本实验至少需要加热_____________次,至少需要称量__________次;
⑶ 某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4·nH2O中n的值(用ml、m2、m3表示):
ω= ____________________,n = _____________________
⑷ 若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生结果偏高还是偏低? _______________
从下列分析中选出该生实验产生误差的原因可能是(填写字母) ___________________
A、加热前称量时容器未完全干燥 B、最后两次加热后的质量差大于0.1g
C、加热后容器未放在干燥容器中冷却 D、加热过程中有少量晶体溅出
E、加热后的粉末中有少量黑色固体
19.(6分)化工行业已合成有一种硬度比金刚石还大的晶体——氮化碳,若已知氮在该化合物中显—3价,试推断:
⑴ 其化学式可能是___________________。
⑵ 其晶体类型是______________________。
⑶ 你认为其硬度比金刚石还大的主要原因是________________________________________。
20.(10分)如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
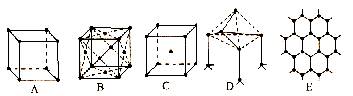
⑴ 其中代表金刚石的是(填编号字母,下同)______________,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于_________晶体。
⑵ 其中代表石墨的是_____________,其中每个正六边形占有的碳原子数平均为______个。
⑶ 其中代表NaCl的是___________。
⑷ 代表CsCl的是_____________,它属于___________晶体,每个Cs+与______个Cl—紧邻。
⑸ 代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹ 上述五种物质熔点由高到低的顺序是_______________________________。
21.(8分)参照下表中物质的熔点,回答有关问题:
① 钠的卤化物及碱金属的氯化物的熔点高低取决于其______________________,
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点℃ | -90.2 | -70.4 | 5.2 | 12.05 | -70.4 | -49.5 | -36.2 | -15.0 |
在这种情况下,____________越大,________________越弱,故熔点依次降低。
② 硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其_______________,
___________________越大,___________________越大,故熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由于_______________
______________________________________________________________。
[参考答案]
一.选择题
1.C 2.C 3.B 4.B 5.A 6.D 7.D 8.C
二. 选择题
9.BC 10.B 11.BC 12.D 13.A 14.C 15.AB 16.A
三.填空题
17. (1)红棕色 H2Se (2)氧化性逐渐减弱 Cl2+2Br—=2Cl—+Br2
(3)随着相对分子质量增大,沸点逐渐升高 (4)HF、H2O 分子之间易形成氢键
18.(1) A、B、D、F、G、J;泥三角、坩埚钳、干燥器
![]()
(2) 2 4
(4) 偏高; A、D、E
19.⑴ C3N4 ⑵ 原子晶体 ⑶ N原子半径比C原子半径小,C—N键键长比C—C键键长小,
C—N键键能比C—C键键能大,所以C3N4的硬度比金刚石还大。
20.⑴ D,4,原子 ⑵ E;2 ⑶ A ⑷ C;离子;8 ⑸ B;分子;12
⑹ 石墨>金刚石>NaCl>CsCl>干冰
21.① 离子半径的大小 ,离子半径,阴阳离子间的静电作用
② 相对分子质量的大小,相对分子质量,分子间作用力
③ 钠的卤化物形成的晶体是离子晶体,硅的卤化物形成的晶体是分子晶体