2006年广州市B类学校六校联考高三化学模拟试题
说明:1.本试卷分第Ⅰ卷和第Ⅱ卷两部分,共8页,150分.考试时间120分钟.
2.考生必须保持答题卷的整洁,考试结束后,将答题卷和答题卡交回.
可能用到的相对原子质量:N14 O16 Na23 Al 27 Mg24 Fe56 Cu64
第I卷(共67分)
一.选择题(本题有9小题,每题有1个选项正确,每题3分,共27分)
1.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的是
A.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
B.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小,可判断不同反应的反应速率的快慢
D.用原子半径数据,可推断某些原子氧化性或还原性的强弱
|

3.下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
4.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2中不同价态的氯在酸性条件下可以生成C12。下列关于混盐CaOCl 2 的说法不正确的是 A. CaOCl 2 与稀硫酸反应产生1mol Cl2 时转移2mol电子
B. CaOCl 2 的水溶液呈碱性
C. CaOCl 2 具有较强的氧化性
D. CaOCl 2 中氯元素的化合价为+1、-1.
5.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
6. 目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是
A. 该晶体属分子晶体 B. 该分子内原子间都以极性共价键相连接
C. 该物质是一种新化合物 D. 该物质的相对分子质量为2400
7.下列溶液中: ①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.只有① B.①③ C. ①②③⑤ D.②③④⑤
8.泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)
的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤
素的性质相似。以下有关ICN的叙述中正确的是
A、ICN不能和NaOH溶液反应; B、ICN是一种共价化合物;
C、将ICN加入到氯水中可生成I2; D、ICN的晶体是离子晶体。

9.关于右图所示装置的说法正确的是( )
A.电流表指针将不会转动
B.外电路中电流方向是Al→Mg
C.Mg是负极,电极反应式为:Mg-2e-=Mg2+
D.Al是负极,电极反应式为:Al+4OH--3e-=AlO2- +2H2O
二.选择题(本题有10小题,每题有1~2选项正确,每题4分,共40分)
10.学习卤素后发现一种规律,某元素的单质或化合物通过缔合易溶于该元素的化合物中,如I2易溶于KI溶液中,HF易溶于NaF溶液中,属于上述情况的是
A、Br2易用于溴苯中 B、S易用于CS2中
C、S易溶于Na2S溶液中 D、AgF易溶于水中

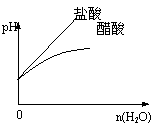
11.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
A、ROH是一种强碱
B、在x点,MOH完全电离
C、在x点,c(M+) = c(R+)
D、稀释前,c(ROH) =10c(MOH)
12、下列实验过程中产生的现象与对应的图形符合的是
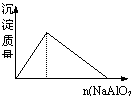 | 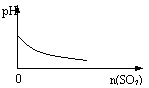 | ||
 A、盐酸溶液中加入NaAlO2; B、SO2气体通入溴水中
A、盐酸溶液中加入NaAlO2; B、SO2气体通入溴水中
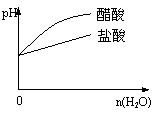
C、pH=2的醋酸与盐酸溶液分别加水稀释; D、氨气通入醋酸溶液中
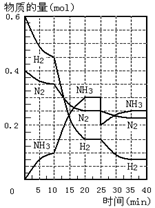
13.500℃、20Mpa时,将H2和N2置于一容积为
2L的密闭容器中发生反应。反应过程中H2、N2
和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速
率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至
20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟 时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
14.将某些化学知识用数轴表示,可以收到直观现象、简明易记的效果。用数轴表示的下列化学知识中不正确的是( )
A.常温条件下,酚酞的变色范围:
![]()
B.分散系的分类:

C.AlCl3和NaOH溶液反应后铝元素的存在形式:
![]()
D.CO2与NaOH溶液反应的产物:
![]()
15、在c(S2-)=0.1mol·L-1的溶液中,可以大量共存的离子组是( )
A、Al3+、NO3-、NH4+、Cl- B、Na+、SO42-、K+、CH3COO-
C、AlO2-、K+、OH-、NO3- D、Na+、NO3-、K+、ClO-
16、某溶液中仅含有Na+、H+、OH-、CH3COO-四种离子,下列说法不正确是
A、在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化
B、溶液中四种离子之间不可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C、当溶液中溶质为CH3COONa和NaOH时,则一定有
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D、当四种离子之间能满足c(CH3COO-)>c(Na+)> c(H+)> c(OH-)时,则溶液中溶质一定是CH3COONa和CH3COOH
17.已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52mol/L,试判断47.5%酒精溶液的物质的量浓度为
A.大于8.26mol/L B.等于8.26mol/L C.小于8.26mol/L D.无法判断
18.下列说法正确的是(填写标号)
(A)配制0.1mol/L的NaCl溶液250mL,只需用以下仪器即可完成:托盘天平(带砝码)、烧杯、玻璃棒、250mL的容量瓶、胶头滴管
(B)快速配制室温时的NaCl饱和溶液不必使用温度计、溶解度表
(C)硅酸钠溶液可以保存在滴瓶中
(D)中和滴定时,眼睛必须注意:①滴定管中液面的变化,②锥形瓶内指示剂颜色的变化,③滴定管下端的液体流速
19.为了提纯下列物质(括号内为杂质),所选用的除杂试剂与除杂方法都正确的是
| 不纯物 | 除杂试剂 | 除杂方法 | |
| A. | 苯(苯酚) | 溴水 | 分液 |
| B. | C17H35COONa(甘油) | 食盐 | 过滤 |
| C. | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D. | 溴苯(Br2) | 乙烯 | 分液 |
第II卷(共83分)
三.(本题包括2小题,共22分)
20.(10分)请按要求填空
⑴下列实验操作或对实验事实的叙述正确的是 (填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
 ③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备
Fe(OH)3胶体;
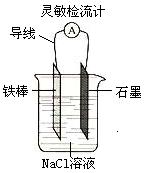
⑦如右图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶
液的现象相同。
![]()
![]()
⑵![]() ①排除碱式滴定管中气泡的方法应
①排除碱式滴定管中气泡的方法应
采用操作 ,(填图编号)轻轻挤压玻璃球使尖嘴部分充满碱液。
甲 乙 丙
②向盛有50mL0.5mol/L盐酸的烧杯中迅速倒入50mL0.55mol/LNaOH溶液,溶液温度上升2. 5℃,则反应的热化学方程式为: 。
21.(12分)实验室用铜与稀硝酸制备NO,采用(1)装置不易观察到无色的NO生成;若用装置(Ⅱ),可达到满意的效果。
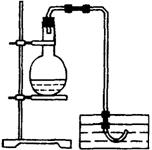 (Ⅰ)
(Ⅰ) 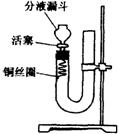 (Ⅱ)
(Ⅱ)
(1)将有关操作补充完全:
①将活塞打开,从U型管的长管口注入稀硝酸,一直注到 为止。
②关闭活塞,用酒精灯在 加热,当 时,立即撤去酒精灯。
(2)回答下列问题:
①反应在什么情况下可以自动停止
可在何处观察到无色的NO气体
②如果再将活塞慢慢打开,可立即观察到哪些明显现象
③如果要获得NO与NO2形成鲜明对照的实验效果,应该继续进行怎样的操作?
四.(本题包括2小题,共20分)
22.(8分)有一瓶澄清溶液,其中可能含有NH4+、Na+、Mg2+、Al3+、Ba2+、Fe3+、SO42—、CO32—、Cl—和I—。取该溶液进行如下实验:
①用pH试纸检验,溶液呈强酸性
②取部分溶液,加入少量CCl4及数滴新制的氯水,振荡后静置,CCl4层呈紫红色
③另取部分溶液,逐滴加入稀氢氧化钠溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④取上述碱性溶液,加入碳酸氢钠溶液,有白色沉淀生成
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
根据上述实验事实确定:
(1)该溶液中肯定存在的离子有__________________。
(2)不能确定是否存在的离子有__________________。
(3)写出反应的离子方程式:
23.(12分)甲、乙、丙、丁四种单质在点燃的条件下反应生成X、Y、Z、
W四种化合物,转化关系如右图所示,又知: ①甲、乙、丙均为短周期元
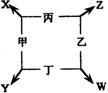 素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无
素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无
色液体,Y是黑色固体;
③丙在乙中燃烧发生苍白色火焰,丁在乙中燃烧生成棕色烟,W的水溶液呈黄色。请填空:
(1)丁在甲和X同时存在的条件下,容易被腐蚀,写出电极反应式:
负极:________________ 正极:_________________________________(2)将饱和W的溶液滴入到热的X中煮沸几分钟,反应的化学方程式为
______________________________________________________________。
(3)Y与足量的稀HNO3反应的离子方程式为:
_____________________________________________________________。
(4)在一定条件下,丁分别Y、Z反应生成等物质的量的丙时,消耗丁的物质的量之比为_______ ___。
五.(本题包括2小题,共21分)
24.(9分)现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是___________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有两种,D的结构简式是__________________________。
25.(12分)为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:
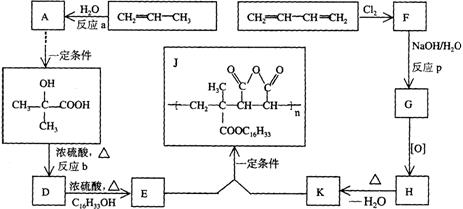
试写出:
(l)反应类型;a 、b 、P
(2)结构简式;F 、H
(3)化学方程式:D→E
E+K→J
六.(本题包括2小题,共20分)
25.(8分) (计算以下两小题时,除必须应用所给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示缺少的数据),并列出计算式。
(1)在温度为t ℃和压强为p Pa的情况下,19.5 g A和11.0 g B恰好完全反应,生成固体C和3.00 L的D气体,计算生成C的质量(m)。
缺少的数据:___________________________。
计算式为m=___________________________。
(2)0.48 g金属镁与10 mL盐酸反应,生成的H2在标准状况下的体积V(H2) 。
缺少的数据:___________________________。
计算式为V(H2)=___________________________。
26.(12分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:
(1)用微粒符号填写下列空格(列举出全部可能的情况)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) ;
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
高三化学模拟试题(二)答题卷 姓名 得分
第I卷(共67分)
一.二选择题答题表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案
|
|
|
|
|
|
|
|
|
|
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
|
|
|
|
|
|
|
|
|
|
第II卷(共83分)
三.(本题包括2小题,共22分)
20.(10分)请按要求填空
⑴ ⑵ ① ,
② 。
21.(12分)
(1)① 。
②用酒精灯在 加热,当 时 。
(2)
① ,
②
③
。
四.(本题包括2小题,共20分)
22.(8分)
(1)该溶液中肯定存在的离子有_____________ _____。
(2)不能确定是否存在的离子有__________________。
(3)写出反应的离子方程式:
。
23.(12分)
(1) 负极:_____ _______ 正极:____________________________
(2)
______________________________________________________________。
(3)
_____________________________________________________________。
(4)______ _ ___。
五.(本题包括2小题,共21分)
24.(9分)
⑴ _____ _ _____;
⑵A的结构简式是____________ ____________;
⑶C的结构简式是__________ _________;
⑷D的结构简式是__________________________。
25.(12分)
试写出:(l)反应类型;a 、b 、P
(2)结构简式;F 、H
(3)化学方程式:D→E
E+K→J
六.(本题包括2小题,共20分)
25.(8分)(1)
缺少的数据:___________________________。
计算式为m=___________________________。
(2)
缺少的数据:___________________________。
计算式为V(H2)=_________________________ __,
26.(12分)
(1)用微粒符号填写下列空格(列举出全部可能的情况)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案
| C | B | D | A | A | B | A | B | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| C
| BD | BD | BC | AC | BC | BC | A | AB | BC |
高三化学模拟试题(二)参考答答案
一.二选择题
选择题答案分析
1. 答案是B
脱氧保鲜的原理是铁的吸氧腐蚀,铁中含碳,构成原电池的二极,滑石粉和乙醇、食盐构成弱碱性电解质。
2.答案是C
A MgCO3微溶,而Mg(OH)2难溶,煮沸时,生成更难溶的Mg(OH)2沉淀。
|
|
Mg(HCO3)2 === MgCO3 + CO2 + H2O MgCO3 + H2O === Mg(OH )2 + CO2
C 反应速率是影响因素是温度、压强、浓度和催化剂,与反应是否吸热、放热无关。
D 同周期元素原子半径越来越小,则得电子越来越易,氧化性越来越强;同主族元素原子半径越来越大,失电子越来越易,还原性越来越强。
3.答案是D
A 原子晶体的熔沸点由共价键的强弱决定,原子间平均距离越小,则共价键越牢固,越不易打断。
B HCl、H2SO4、HNO3等分子晶体在水溶液中也电离出离子。
C 对组成和结构相似的分子晶体,其分子量越大,分子间作用力越大,熔沸点越高。
D 水加热到很高的温度都难以分解,是因为水分子中H—O共价键牢固。
4. 答案选A
根据信息“一种阳离子与两种酸根离子组成的盐称为混盐”,该混盐应写成CaCl(ClO),结构中存在Cl和ClO二种阴离子。
5.答案选A
平衡的标志是各组分的百分含量保持不变或任一物质的正、逆反应速率相等。①颜色不再加深,则NO的浓度不变;②反应向逆反应方向进行时,N2O4 的消耗速率与NO2的生成速率之比为1∶2;⑤气体质量守恒,烧瓶内气体的质量不论是否平衡,都不会变化,⑥烧瓶内气体的压强与气体的总物质的量有关,只有平衡时,气体的总物质的量不变,压强才不变;⑦密度等于质量除以体积,烧瓶内气体的总质量始终不变,烧瓶气体的体积也始终不变,所以烧瓶内气体的密度始终不变;⑧气体平均相对分子质量等于气体总质量除以气体的总物质的量,气体质量始终不变,只有气体的总物质的量不变,M才不再变化。
6. 答案选B
A 题目已给出是“球形分子”
B 足球烯C60的分子容纳在Si60分子中,则球外面硅原子间应是非极性共价键,球里面的碳原子间也应是非极性共价键结合,
C. 该物质是一种新化合物即Si60C60;
7.答案选A
⑤酸化的Ba(NO3)2溶液中存在的离子是Ba2+、NO3—、H+,相当是稀硝酸 3SO2 + 2NO3—+ 2H2O + 3Ba2+ = 2NO↑+ 3BaSO42—↓+ 4H+ ,而CO2在酸性条件下不会与Ba2+生成BaCO3沉淀。
8.答案选B
题示信息:(CN)2和卤素的性质相似,即CN和Cl相似。
A、ICN相当于ICl,能和NaOH溶液反应; B、ICl是一种共价化合物;
C、ICN中的I的价态是+1价,生成I2应是+1碘被还原,而氯水是强氧化剂;
9.答案选D
产生原电池的化学反应 应是自发进行的氧化还原反应。这里Mg和电解质NaOH溶液不能反应,应是Al和NaOH溶液发生的氧化还原反应放出的能量通过该装置产生电流。
10.答案选C
I2易溶于KI溶液中,缔合为I3—,HF易溶于NaF溶液中,缔合为NaHF2
C、S易溶于Na2S溶液中,缔合为Na2Sx (多硫化物)
11.答案选BD
A、图中ROH起始pH为13,稀释100倍,pH变为11,所以是强碱。
B、MOH稀释100倍,pH由12变为11,所以为弱碱,不可能完全电离
C、在x点,由于二者的氢离子浓度相等,所以c(M+) = c(R+)
D、ROH是强碱,而MOH是弱碱,二者pH值相差1,氢离子浓度相差10倍,而二种碱的浓度相差小于10倍。
12、答案选BD
A 盐酸溶液中加入NaAlO2,酸过量,刚开始滴NaAlO2时,没有沉淀生成,当H+反应完全生成Al3+后,再滴加NaAlO2才生成沉淀。(如下图左)
4H + AlO2— = Al3+ + 2H2O Al3+ + 3AlO2— + 6H2O = 4Al(OH)3↓
B、SO2气体通入溴水中SO2 + Br2 +2H2O= H2SO4+2HBr,酸性增强,pH下降。
 C 醋酸在稀释时,由于溶液中醋酸分子的电离,使cH下降没有盐酸快,即pH值上升没有盐酸快。 (如下图右)
C 醋酸在稀释时,由于溶液中醋酸分子的电离,使cH下降没有盐酸快,即pH值上升没有盐酸快。 (如下图右)
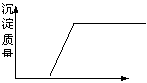 | |||
| |||
![]()
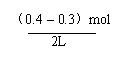 13.答案选BC
13.答案选BC
A 第一次平衡的时间是20分钟, v(N2) = c(N2) / △t = 20min
= 0.0025mol/(L·min)—1
B.从曲线变化可以看出,反应进行到10min时,反应速率突然加快,可能的原因是:升温、加压或使用了催化剂
C.反应进行至25min钟时,氨气的浓度突然减小0.1mol后又增大,而N2和H2的浓度从平衡点开始减小,平衡向正反应进行,分离出0.1mol的氨气。
D.达到新平衡后NH3的体积分数大小难以确定。
![]() 14.答案是BD
14.答案是BD
![]() A.常温条件下,酚酞的变色范围是
pH
A.常温条件下,酚酞的变色范围是
pH
无色 粉红色 红色
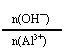
![]() C.AlCl3和NaOH溶液反应后铝元素的存在形式:
C.AlCl3和NaOH溶液反应后铝元素的存在形式:
Al(OH)3 Al3+ Al(OH)3 Al(OH)3 AlO2— AlO2—
15、答案是BC
在c(S2-)=0.1mol·L-1的溶液中,溶液呈碱性,还要考虑S2—具有还原性
A、为酸性溶液- C、NO3-在碱性条件下没有氧化性, D、HClO是极弱的酸,则ClO-易水解生成HClO,具有强氧化性,可氧化S2—
16、答案是:BC
A、上述溶液可以是CH3COONa –CH3COOH的混合溶液,也称缓冲溶液,对酸、碱都有缓冲作用,加少量的NaOH或HCl溶液时引起平衡移动很小,溶液的pH不会发生显著变化,如人体血液中的HCO—–H2CO3缓冲体系也是这样,对酸和碱具有一定的缓冲作用,使人体血液的pH维持在7.35 – 7.49之间。
B、CH3COONa溶液中,离子浓度大小:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C、若NaOH的量很少时,则关系应是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
17.答案是:A
此类题可设计为:乙醇溶液质量分数由95%加水稀释变为47.5%,可认为是乙醇和水等质量混合而得。当乙醇和水等质量时,水的体积小于乙醇的体积,
即:m乙醇 = m水 ,V水 < V乙醇 ,n混 = n乙醇 所以V总 < 2V乙醇 ,
则 n混 = n混 / V总 > 原乙醇物质的量浓度的一半。
18.答案选AB
(D)中和滴定时,眼睛必须注意:锥形瓶内溶液颜色的变化,滴定管下端的液体流速开始快,越接近终点,越慢。
19.答案选BC
A 苯中苯酚,苯酚和Br反应生成三溴苯酚可溶于苯中,应用NaOH溶液,生成苯酚钠溶于水,再分液。
D 溴苯中溴,溴和乙烯加成生成卤代烃可溶于溴苯中,应用NaOH溶液,生成溴化钠和次溴酸钠均溶于水,再分液。
第II卷(共83分)
三.(本题包括2小题,共22分)
20.(10分) ⑴ ②⑤⑦ ⑵ ① C ,
② HCl(aq) + NaOH(aq) = NaCl(aq) + H2O(l) △H = - 41.8KJ/mol 。
21.(1)① 液面达到分液漏斗活塞处。②U形管短管一侧,铜丝圈上有气泡 。
(2)
①当产生的NO气体将稀HNO3压入长管内,使铜丝圈和稀HNO3液面脱离后;U形管短管内可观察到无色的NO
② 长管内的HNO回落,二边液面相平,铜丝圈表面又产生气泡,分流漏斗中有红棕色气体出现。
③再关闭分液漏斗活塞,使Cu和HNO3反应又产生无色的NO气体。
四.(本题包括2小题,共20分)
22.(8分)
|
NH4+ + OH— = NH3↑+ H2O ; HCO3—+ OH—+ Ba2+ = H2O + BaCO3↓。
23.(12分)
|
(2)FeCl3 + 3H2O(沸) = Fe(OH)3胶体 + 3HCl。
(3) 3Fe3O4 + 28H+ + NO3— = 9Fe3+ + NO + 14H2O (4) 3 :4。
五.(本题包括2小题,共21分)
24.(9分)
⑴ 设A的分子量为M,A中C原子数为x,则有:12x /M = 72%,
讨论得:x = 9时,M = 150符合题意。 A的分子式C9H10O2;H%=6.67%
⑵C6H5CH2CH2COOH;
⑶ HOCH2 – C6H5 – CHO(对位) ⑷ O2N – C6H5 – CH(CH3)2 (对位)
25.(12分)
(l)加成 消去 取代(水解)
(2)ClCH2–CH = CH-CH2Cl HOOC-CH=CH-COOH
(3)CH2=C(CH3)COOH + C16H33OH ----- CH2 = C(CH3)COOC16H33 + H2O
略
六.(本题包括2小题,共20分)
25.(8分)(1)该条件下D气体的密度,设为a g/L。
m= 19.5 + 11.0 – 3.00a。
(2 盐酸的浓度 设为bmol/L。
当酸过量时, 按Mg计算H2,V(H2)= 0.448L
当金属过量时,按酸计算H2 ,V(H2) = 0.112bL
26.(12分)
(1)用微粒符号填写下列空格(列举出全部可能的情况)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | Fe、Cu | Cu | Cu | |||
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+ Cu2+ | Fe2+、Fe3+ Cu2+ | Fe3+、Cu2+ |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)
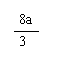 | |||
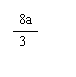 | |||
≥ b > a(1 – x)
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
a = 0.04mol b = 0.12mol