§6-2 性质实验方案的设计
班级 座号 姓名
一、选择题(每小题只有一个正确答案。)
1、下列试纸在使用前不能用水润湿的是( )
A、蓝色石蕊试纸 B、碘化钾淀粉试纸
C、广泛pH试纸 D、醋酸铅试纸
2、用托盘天平称取一盛有粉剂的烧杯,若在左盘上放置20 g砝码,当天平指针指零时,游码位置如图所示(5 g 以下用游码),则烧杯和粉剂的质量是 ( )
![]()
A、2.5 g B、17.5 g C、20.0 g D、22.5 g
3、按下列方法制备气体,合理而又实用的是( )
A、锌粒与稀硝酸反应制备H2 B、向饱和NaCl溶液中滴加浓H2SO4制备HCl
C、大理石与浓硫酸反应制备CO2 D、亚硫酸钠与浓硫酸反应制备SO2
4、要安装一套实验室利用液体和液体反应制备气体的装置,现设计了五步操作,正确的操作步骤是( )
①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗加入另一种液体反应物,并将导气管放入气体收集器中 ④检查装置的气密性(利用固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A、②①⑤④③ B、④①②⑤③ C、①②⑤④③ D、①⑤④②③
5、提纯少量含碳酸氢钠杂质的碳酸钠固体所需用的仪器为( )
①试管 ②泥三角 ③蒸发皿 ④试管夹 ⑤坩埚⑥玻璃棒 ⑦石棉网 ⑧坩埚钳
A、①④ B、②⑤⑧ C、③⑥ D、⑥⑦
6、下列除去杂质的方法正确的是( )
A、除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B、除去CO2中少量HCl:通入Na2CO3溶液,收集气体
C、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后过滤
D、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
7、现有三组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合物的正确方法依次为 ( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
8、下列实验不需要水浴加热的是( )
A、银镜反应 B、溶解度的测定 C、乙酸乙酯的制取 D、硝基苯的制取
9、仅利用两两混合法而不用其他试剂,可以鉴别出氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠中的( )
A、一种 B、两种 C、三种 D、四种
10、下列实验操作,仪器需插入液面以下的有( )
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管 ②制取H2的简易装置中长颈漏斗的下端管口 ③分馏石油时控制温度所用的温度计 ④用乙醇制备乙烯时所用的温度计 ⑤用水吸收NH3时的导气管 ⑥向试管中的BaCl2溶液中滴加稀H2SO4所用的胶头滴管
A、③⑤⑥ B、②⑤ C、①②④ D、①②③④⑤⑥
11、下列实验操作正确的是( )
A、将氢氧化钠固体放在滤纸上称量 B、用10 mL量筒量取8.58 mL蒸馏水
C、制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水法收集
D、配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
12、实验室用溴和苯反应制取溴苯,得到粗溴苯后要用如下操作精制,正确的操作顺序
是( )
①蒸馏 ②水洗 ③用干燥剂干燥 ④用10% NaOH溶液洗 ⑤水洗
A、①②③④⑤ B、②④⑤③① C、④②③①⑤ D、②④①⑤③
13、拟用如下方法区别有关物质:①用品红溶液区分CO2和SO2两种气体; ②用FeCl3溶液区分苯酚和苯溶液; ③用湿润的淀粉碘化钾试纸区分NO2和溴蒸气; ④用溴水区分苯和CCl4两种液体; ⑤用NaOH溶液区分NH4Cl和NH4NO3两种溶液。这些方法正确的是( A )
A、①②④ B、①②③ C、②③④ D、①②⑤
二、填空题
14、浓硫酸与乙二酸(H2C2O4)在加热条件下反应的化学方程式为:
H2C2O4![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
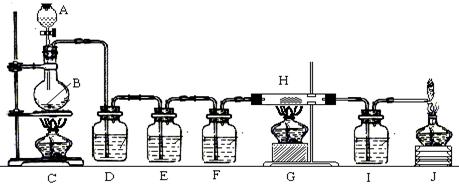
有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如图所示的装置。其中A和F中各盛有浓硫酸,B中盛有乙二酸,D中盛有氢氧化钠浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
(1)D装置的作用是_____________________________________。
(2)E装置的作用是____________________________________。
(3)I装置的作用是____________________________________。
§6-2 性质实验方案的设计
参考答案
一、选择题(每小题只有一个正确答案。)
1、C 2、B 3、D 4、A 5、A 6、C 7、C 8、C 9、D 10、C
11、D 12、B 13、A
二、填空题
14、(1)除去混合气体中的CO2 。
(2)检验混合气体中二氧化碳是否已全部被吸收 。
(3)石灰水变浑浊,说明生成了CO2,从而证明实验过程中CO还原了铁的氧化物CO2