元素化合物综合练习(三)
命题:李慎行 2004.2.9
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.我国“神舟五号”航天飞船成功发射升空,表明我国的载人航天技术已经有了突破性的进展。在运送飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混合反应后的产物之一是
A.氧气 B.氮气 C.氨气 D.氢气
2.下列物质露置于空气中易变质的是
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A.除⑤外 B.除②③外 C.除②③⑥外 D.全易变质
3.下列各组中的物质相互作用,水既不是氧化剂,又不是还原剂,且反应属于氧化—还原
反应的是
A.氟气与水 B.铝与氢氧化钠溶液
C.二氧化氮与水 D.五氧化二磷与冷水
4.2003年2月1日美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨
A.具有导电性、防辐射 B.密度小,减轻机身重量
C.熔点高、化学性质稳定 D.硬度小,有润滑作用
5.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢
中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列
判断正确的是
A.H3+可在液氢中开成H5+、H7+、H9+ B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+ D.H3+可广泛存在于固态、液态和气态氢中
![]()
![]() 6.根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
6.根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
该方案的目的是为了制备
A.HBr B.CaO C.H2 D.Hg
7.近年来,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效催化剂,使SiO2分解产生硅同时释放能量,是硅能源大规模开发利用的一项关键技术
8.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个进行沉淀分离,加入下列离子的先后顺序正确的是
A.CO32-、Cl-、OH- B.Cl-、OH-、CO32-
C.OH-、Cl-、CO32- D.CO32-、OH-、Cl-
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.W g镁和铝的混合物,跟足量的稀硫酸反应产生的H2体积是等质量该混合物跟足量烧碱溶液反应产生H2体积的4倍(相同状况),则原混合物中镁和铝的质量比为
A.4:1 B.2:3 C.5:2 D.1:4
10.某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,现将此混合气体经过浓硫酸后体积减小,将剩余气体排入空气中,很快变成红棕色。对于原混合气体成分的判断中,正确的是
A.肯定有O2 B.肯定没有Cl2、NH3、NO2
C.肯定有NH3、NO、HCl D.肯定只有NH3和NO
11.痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是
A.①AgNO3②NaBr③AgBr B.①AgNO3②NaCl③AgCl
C.①AgCl②AgNO3③NaCl D.①AgNO3②NaI③AgI
12.下列反应的离子方程式正确的是
A.苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2++SO42-=BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓
D.氯化亚铁溶液中滴入溴水:2Fe2++Br2=2Fe3++2Br-
13.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83gX中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应, 得到3.81g I2, 反应中Cr2O72-又生成2Cr3,若向溶有2.83gX的溶液中加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.3K2SO4·Cr2(SO4)3
14.二战期间丹麦科学家玻尔被迫离开德军占领的祖国。为了表明一定要返回祖国的决心,他把自己获得的金质诺贝尔奖章放在盛有王水的玻璃瓶中留了下来:Au+ HNO3+ 3HCl= AuCl3+ NO↑+ 2H2O;战后玻尔从溶液中提取金,又重新铸成了奖章,下列方法中,你认为不能从溶有黄金的王水中提取金的是
A.用铁置换 B.电解其水溶液
C.先蒸发水分后灼烧固体 D.过滤
15.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是
A.氢氟酸的酸性比其它酸强
B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强
D.钛离子易与氟离子形成可溶性难电离物质
16.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律。如:Na2O2+SO2 == Na2SO4、Na2O2+SO3 == Na2SO4+ O2,据此,你认为下列方程式中不正确的是
A.2Na2O2+2Mn2O7==4NaMnO4+O2↑
B.2Na2O2+P2O3==Na4P2O7
C.2Na2O2+2 N2O3==4NaNO2+O2↑
D.2 Na2O2+2 N2O5 ==4NaNO3+O2↑
17.用稀H2SO4、NaOH溶液和铝屑为原料制取Al(OH)3,甲、乙、丙三个学生通过三种不同的途径制备
H2SO4 NaOH
![]()
![]() 甲:Al
Al2(SO4)3
Al(OH)3
甲:Al
Al2(SO4)3
Al(OH)3
NaOH H2SO4
![]()
![]() 乙:Al
NaAlO2
Al(OH)3
乙:Al
NaAlO2
Al(OH)3
H2SO4
![]()
![]() 丙:Al
Al2(SO4)3
丙:Al
Al2(SO4)3
![]() NaOH
Al(OH)3
NaOH
Al(OH)3
![]() Al
NaAlO2
Al
NaAlO2
A.乙消耗的原料最少 B.三者消耗的原料相同
C.丙消耗的原料最少 D.甲、乙消耗的原料相同
18.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是
A.向Fe、FeO和Fe2O3的混合物中加入过量的盐酸
B.等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液
C.等物质的量的 NaHCO3与 Na2O2固体
D.在NaBr溶液中通入过量氯气
三、简答填空(20分)
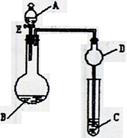 19.(11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
19.(11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 .
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸
(H2S)饱和溶液,旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,
旋开E后,C中的现象是 ;继续通气体于C中,
足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液
中I2能被Cl2氧化为HIO3,写出该反应的化学方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的方程式为 。
(5)该题图示装置有多种用途,请举一例(除题中之外)填空:A为 ,B为 ;C中盛 ,其目的为 。
20.(9分) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的含氧酸,同时放出气体,该气体混合物经干燥后,平均相对分子质量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝后又褪色。试完成下列各题:
(l)该气体的组成是___________,气体混合物的物质的量比为_______________。
(2)写出氯酸分解方程式并配平________________________________________。该反应的还原产物是_________________________(写化学式)。
(3)结合化学反应方程式解释,该气体使润湿的淀粉一碘化钾试纸变蓝后又褪色的原因:______________________________,____________________________________。
四、分析推理(14分)
 21.(8分)某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略):
21.(8分)某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略):
(1)写出下列物质的化学式:
试剂x 、试剂z 。
晶体E 、固体G 。
(2)写出下列反应的离子方程式:
沉淀A+试剂y: 。
滤液D+过量CO2: 。
22.(6分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
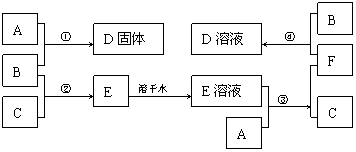
请回答:
(1)写出A、B、C的化学式。
A: B: C:
(2)反应①的化学方程式为:
(3)反应③的化学方程式为:
(4)反应④的离子方程式为:
五、实验探究(12分)
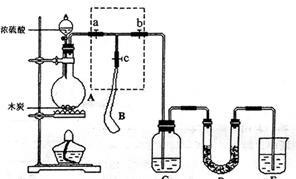
23.(12分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图11所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
|
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是
;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水b;
(3)实验时,装置C中的现象为 ;
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的的CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为
六、计算题(8分)
24.(8分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为正整数,且2<b<6,![]() ),有的还含一定数目的结晶水,其组成随反应条件不同而
),有的还含一定数目的结晶水,其组成随反应条件不同而
异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH20(c也是正整数),已知a+b+c=9。
取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P2O5的U型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水的碱式硫酸铜的化学组成。
元素化合物综合练习(三)
参考答案
| 1 | B | 2 | D | 3 | C | 4 | C | 5 | A |
| 6 | C | 7 | D | 8 | B | 9 | A | 10 | D |
| 11 | B | 12 | D | 13 | C | 14 | D | 15 | D |
| 16 | C | 17 | C | 18 | C |
| |||
19.(1)防止倒吸
(2)溶液变浑浊;2H2S+O2====2S↓+2H2O
(3)溶液变蓝色;I2+5Cl2+6H2O====2HIO3+10HCl
(4)有白色胶状沉淀;Al3++3NH3·H2O====Al(OH)3↓+3NH4+
(5)A.稀硫酸; B.硫化亚铁; C.硫酸铜溶液;验证硫化氢气体的产生(答案不唯一,酌情给分)。
20.⑴ Cl2 O2 2:3 ⑵8HClO3 == 2Cl2↑+3O2↑+4HClO4+2H2O;Cl2
⑶ Cl2 +2KI=2KCl+I2 I2 与淀粉显蓝色, Cl2 + H2O =HCl+ HClO HClO具漂白性。
21.
(1) NH3·H2O C6H12O6(葡萄糖或CH3CHO等含醛基的有机物) FeSO4·7H2O Al2O3
(2) Al(OH)3+OH-=AlO2-+2H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
22.(1)A:Fe B:Cl2 C:H2 (2)2Fe +3Cl2 2FeCl3
(3)Fe +2HCl FeCl2 + H2↑ (4)2Fe2+
+Cl2 2Fe3+
+2Cl-
23.(1)关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好(答案合理均给分)(2)③①②(3)品红溶液褪色
(4)A;除去SO2并检验SO2已被除净
24.(1)该碱式硫酸铜的化学式为 CuSO4·3Cu(OH)2
(2)根据题意,1.26g为样品加热生成水蒸气的质量,5.60g为样品分解生成CuO的质量。
n(CuO):n(H20)=![]() ∶
∶![]() =0.07∶0.07=1∶1 即a+b=b+c 所以a=c 因
=0.07∶0.07=1∶1 即a+b=b+c 所以a=c 因![]() <
<![]() <
<![]() a+b+c=9
a+b+c=9
若a=c=1 b=7 不符 a=c=2 b=5 符合 a=c=3 b=3 不符合 a=c=4 b=1 不符合
所以该含结晶水的碱式硫酸铜的化学式为 2CuSO4·5Cu(OH)2·2H20