蒙自高级中学2007届2月月考高三理综(化学部分)模拟试卷
可能用到的相对原子质量: C-12 H- 1 O-16 S-32
一、选择题
6.下列说法中,你认为不科学的是 ( )
A.绿色食品是指不含任何化学物质的食品
B.食用含碘食盐可预防甲状腺肿大
C.使用含氟牙膏可预防龋齿
D.光导纤维是以二氧化硅为主要原料制成的高性能通讯材料
7.下列物质按纯净物、混合物、电解质和非电解质顺序排列的是( )
|
| 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐 酸 | 空 气 | 醋 酸 | 二氧化碳 |
| B | 冰醋酸 | 福尔马林 | 硫酸钠 | 乙 醇 |
| C | 蛋白质 | 油 脂 | 苛性钾 | 石灰石 |
| D | 胆 矾 | 漂白粉 | 氯化钾 | 硫酸钡 |
8.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3—、Na+
B.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3—、Na+
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、Cl—、
D.在能使pH试纸变红色的溶液中:Na+、S2—、NO3—、CO32—
9.某学生的实验报告中有下列数据,其中合理的是 ( )
①用托盘天平称取11.7g氯化钠 ②用100mL的量筒量取21.48mL盐酸
③用容量瓶配制216mL,1mol·L-1的氯化钠溶液 ④用酸式滴定管量取25.00mL H2SO4溶液 ⑤用pH试纸测定H2SO4溶液的pH为3.2
A.①④ B.②④ C.①③ D.②⑤
10.往HI溶液中滴加淀粉溶液无任何现象,但加入某物质后溶液立即变蓝,该物质可能是 ( )
①氯水 ②Na2SO3溶液 ③KNO3溶液 ④FeCl3溶液 ⑤Na2S溶液
A.①②③④⑤ B.①③ C.①④ D.①③④
11.四种短周期主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m > n,则下列叙述的判断正确的是:
( )
①a-b = n-m ②元素的原子序数a > b > c > d ③元素非金属性Z > R
④最高价氧化物对应水化物碱性X > Y ⑤离子半径Xm+ < Yn+ < Zn- < Rm-
A.②③⑤正确 B.只有③正确
C.①②③④⑤正确 D.①②③正确
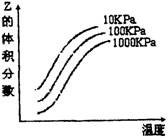
![]() 12.右图是温度和压强对X
+ Y 2Z反应影响的示意图。
12.右图是温度和压强对X
+ Y 2Z反应影响的示意图。
|
的体积分数。下列叙述正确的是 ( )
![]() A.X + Y 2Z反应的逆反应的△H>0
A.X + Y 2Z反应的逆反应的△H>0
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.降低温度Y的转化率升高
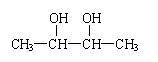 13.下列各化合物中,能发生酯化、还原、加成、消去四种反应的物质是: (
)
13.下列各化合物中,能发生酯化、还原、加成、消去四种反应的物质是: (
)
A.CH3—CH = CH—CHO B.
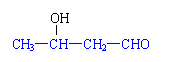 | 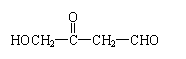 | ||
C. D.
二、填空题
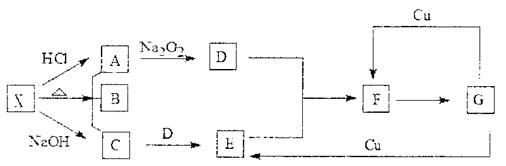
|
(1)A在特殊状态下形成固体的俗名 ,属 晶体,
(2)C分子空间构型为 ,属 (填极性分子或非极性分子)
(3)写出X→A+B+C化学方程式: 。
写出G和Cu反应生成E的离子方程式 。
(4)将F气体装入密闭玻璃小球中进行如下实验:当把小球置于热水中,观察到气体颜色加深;当把小球置于冰水中,观察到气体颜色变浅。请结合有关化学原理,给予合理的解释:
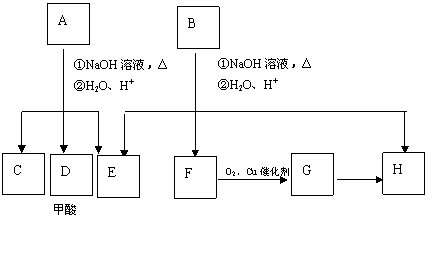
27. (15分)芳香化合物A、B互为同分异构体,B的结构简式是
O O
|
CH3CO COCH2CH3
A经①、②两步反应得C、D和E. B经①、②两步反应得E、F和H. 上述反应过程、产物性质及相互关系如图所示.
 |
|
|
|
|
(2)A可能的结构有 种,写出其中任意一种的结构简式 .
(3)在B、C、D、F、G化合物中,互为同系物的是 (填代码).
(4)写出F→G的化学方程式:
(5)B与氢氧化钠溶液共热的化学方程式: ,反应类型是 .
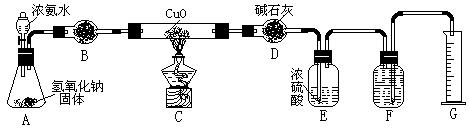 |
28.(16分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
⑴写出氨气与氧化铜反应的化学方程式:2NH + 3CuO 3Cu + N+ 3HO
⑵在A的锥形瓶中放入NaOH固体的目的是利用NaOH的碱性和遇水放热的性
⑶在干燥管B中不能选用的干燥剂是 C (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢气化钠
⑷在C的玻璃管中观察到的现象是:黑色固体变成了亮红色 。
⑸E装置中盛装浓硫酸的作用是:吸收多余的NH ;
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,则被还原的氧化铜的物质的量为:3a/22.4mol;若测得干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)9a/11.2b 。
29.(14分)根据要求作答:
(1)按要求写出相关反应的离子方程式:
a、向亚硫酸氢铵溶液中滴加过量的氢氧化钠溶液: ;
b、向氯化亚铁溶液中通入过量的氯气: 。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为
又已知H2O(l) = H2O(g);△H = +44kJ/mol,则0.5mol乙硼烷完全燃烧生成气态水时放出的热量是 kJ。
(3)已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+) > c(HSO3-) > c(SO32-) > c(H2SO3yc) ,则该溶液中:
电离程度 水解程度(填“>”“<”“=”),简述理由:
蒙自高级中学2007届2月月考高三理综(化学部分)模拟试卷答案
一、选择题
6、A 7、B 8、B 9、A 10、D 11、A 12、C 13、C
二、填空题 (除特别注明为每空3分,其余均为每空2分)
26、(15分)
(1)干冰、分子晶体 (2)三角锥形、极性分子
![]() (3)NH4HCO3=NH3↑+H2O↑+CO2↑
3Cu+8H++2NO—3=3Cu2++2NO↑+4H2O(4)2NO2 N2O4;△H<0,升高温度,平衡向吸热反应方向进行,即生成NO2的方向,降低温度,平衡向放热反应的方向进行,即生成N2O4的方向。(3分)
(3)NH4HCO3=NH3↑+H2O↑+CO2↑
3Cu+8H++2NO—3=3Cu2++2NO↑+4H2O(4)2NO2 N2O4;△H<0,升高温度,平衡向吸热反应方向进行,即生成NO2的方向,降低温度,平衡向放热反应的方向进行,即生成N2O4的方向。(3分)
|
|
|
HCOO— —COOCH2CH2CH3 HCOO— —COOCH(CH3)2
 (3)C和F
(3)C和F
(4)2CH3CH2OH+O2 2CH3CHO+2H2O↑
(5)
O O
|
|
CH3CO COCH2CH3 +3NaOH→CH3COONa+ NaO COONa + C2H5OH
+H2O
水解或取代
28、(16分)
⑴2NH3 + 3CuO
![]() 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
⑵利用NaOH的碱性和遇水放热的性质,使NH3·H2O 分解后逸出
⑶ C (填序号); ⑷黑色固体变成了亮红色
⑸吸收多余的NH3 ⑹3a/22.4mol;9a/11.2b (6分)
29、(14分)
(1)NH4++HSO3-+2OH-=NH3↑+2H2O+SO32- 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
(2)B2H6(g) + 3O2(g) == B2O3(s) + 3H2O(l);△H =-2165kJ/mol;1016.5kJ(3分)
![]() ①>;亚硫酸氢钠溶液,存在HSO3-的电离平衡:HSO3- H+ + SO32-;
①>;亚硫酸氢钠溶液,存在HSO3-的电离平衡:HSO3- H+ + SO32-;
![]() 还有HSO3-的水解平衡:HSO3-+ H2O H2SO3 +
OH-。由题给信息c(SO32-) > c(H2SO3)可得出,上述电离程度比水解程度强。(3分)
还有HSO3-的水解平衡:HSO3-+ H2O H2SO3 +
OH-。由题给信息c(SO32-) > c(H2SO3)可得出,上述电离程度比水解程度强。(3分)