2003年高三化学月考试题(统编)
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。总分150分,考试时间120分100钟。
第Ⅰ卷(选择题,共74分)
|
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列说法错误的是 ( )
A.铅笔不含铅 B.水银不含银 C.白金不是金 D.重水不是水
2.下列物质属于原子晶体的化合物是 ( )
A.金刚石 B.刚玉 C.水晶 D.干冰
3.对于下列事实的解释错误的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
4.某有机物分子式C16H23Cl3O2,分子中不含环和叁键,则分子中的双键数值为 ( )
A.5 B.4 C.3 D.2
5.化学实验中常将溶液或试剂进行酸化、碱化,下列处理方法正确的是 ( )
A.检验C2H5Cl时,将C2H5Cl和NaOH溶液混合加热后,加入稀H2SO4进行酸化
B.为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸进行酸化
D.进行乙醛银镜实验时,常在新配制的银氨溶液中滴入少量稀氢氧化钠溶液
6.下列说法中正确的是(NA表示阿伏加德罗常数的值) ( )
A.SiO2晶体中,1mol硅原子与氧原子形成的共价键数是2NA
B.标准状况下,1L己烷所含碳原子个数约为6NA/22.4
C.3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.常温常压下,0.1mol氖气含有的电子数为1NA
7.下列物质间能反应产生氢气,且产生H2速度最快的是 ( )
A.锌与6mol/LHNO3 B.锌与6mol/LHCl
C.锌与18mol/LH2SO4 D.锌与2mol/LH2SO4
8.在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物。如用
CH3C≡CH合成CH2=C(CH3)COOCH3,欲使原子利用率达到最高,还需要的反应物是( )
A.H2和CO2 B.CO2和H2O C.CO和CH3OH D.CH3OH和H2
|
9.在pH=1的无色透明溶液中,不能大量共存的离子组是 ( )
A.Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、S2-、Cl- D.Zn2+、Na+、NO3-、SO42-
10.pH相同的醋酸和盐酸,分别用水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相
等,则m和n的关系是 ( )
A.m=n B.m>n C.m<n D.无法比较
|
11.中草药秦皮中含有的七叶树内酯 (每个折点表示一个碳原子,氢原子未
完全画出),具有抗菌作用。若1mol七叶树内酯分别与浓溴水和氢氧化钠溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
A.2molBr2、2molNaOH B.2molBr2、3molNaOH
C.3molBr2、4molNaOH D.4molBr2、 4molNaOH
12.在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,
现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1∶2∶4,则参加反应的铁
粉与原溶液Fe3+的物质的量之比为 ( )
A. 2∶1 B.1∶2 C.1∶3 D.1∶4
13.用两支惰性电极插入500mLAgNO3溶液中,通电电解,当电解液的pH从6.0变为3.0
时(设电解时阴极没有H2析出,且电解前后溶液体积不变),电极上应析出银的质量
是 ( )
A.27 mg B.54 mg C.108mg D.216 mg
14.在高温下,反应2HBr(气) ![]() H2(气)+Br2(气);△H>0,达到平衡时,要使混合气体
H2(气)+Br2(气);△H>0,达到平衡时,要使混合气体
颜色加深,可采用的方法是 ( )
A.减小压强 B.缩小体积 C.升高温度 D.增大c (H2)
15.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,
经测定Na2O2无剩余,则最后的固体的物质的量为 ( )
A.1~2mol之间 B. 1~4mol之间 C.2~4mol之间 D. 大于4mol
16.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电
子层结构,B2-具有与Ar相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第Ⅲ族的元素 D.B是第3周期ⅥA族的元素
17.下列溶液中通入SO2后最终一定出现沉淀的是 ( )
A.Ba(NO3)2溶液 B.BaCl2溶液
C.Ba(OH)2溶液 D.氢硫酸(H2S)
18.空气和二氧化碳按体积5:1混合,将混合气体与足量的红热焦炭充分反应。设空气中氮
气和氧气的体积比为4:1,不计其他成分,且体积都在同温、同压下测定的,则反应后
的气体中一氧化碳的体积分数是 ( )
A. 29% B. 43% C. 50% D. 100%
第Ⅱ卷(非选择题 共76分)
|
三、(本题包括2小题,共25分)
19.(6分)利用图1所示装置收集以下8种气体(图中烧瓶中的位置不得变化):
a.H2,b.Cl2,c.CH4,d.HCl, e.NH3,f.NO, g.H2S,h.SO2
 ①若烧瓶是干燥的,则由B口进气可收集的气体有
①若烧瓶是干燥的,则由B口进气可收集的气体有
(写序号下同)。
②若烧瓶充满水,可收集的气体有 ,这时气体由 口进入。
③若烧瓶是干燥的,则A口进气,可收集的气体有 。
④若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置来干燥的气体
有 ,这时气体由 口进入。
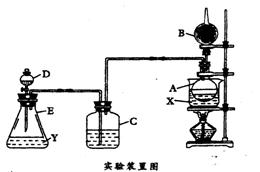 20.(19分)为证明乙醇分子中含有氧原子,现采用一套装置进行实验。试根据以下装置图、
20.(19分)为证明乙醇分子中含有氧原子,现采用一套装置进行实验。试根据以下装置图、
试剂及实验现象,回答有关问题。
Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,
内放无水盐X;②B干燥管里装生石灰;
③C和D中都装浓硫酸;④E瓶中装入试剂Y
实验操作及现象是:
Ⅱ.用水浴加热A瓶;将D中浓硫酸缓缓滴入E
中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,在B管口挥
发的气体可点燃。请回答下列各问题:
(1)E瓶里所装的试剂Y是以下的__________。
A. 饱和食盐水; B. MnO2和NaCl的混合物; C. 浓盐酸
(2)D中浓硫酸所起的作用是_______________________________;C瓶中浓硫酸所起的
作用是__________________________。
(3)A瓶中发生反应的化学方程式是__________________________________;反应类型
是____________;所生成的__________(写名称)在B出口处点燃。
(4)无水盐X宜选用_________,它能起指示作用的原因是______________________。
(5)此实验能证明乙醇分子中含有氧原子的理由是______________________
______________________________________________________________。
(6)如果将装置中的C瓶取掉,实验目的是否能达到_________;因为______________________ 。
|
四、(本题包括2小题,共22分)
21.(8分)(1)常温下,高锰酸钾跟浓盐酸反应,可生成氯气,同时MnO4-被还原成Mn2+。
写出这一氧化还原反应的离子方程式 。
(2)将H2S跟浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是H2SO4,反应物HNO3的还原产物是NO,生成物中还有水,写出这一反应的化学方程式 。
如反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是 L,这些NO全部被氧化为NO2,需O2的体积为 L(标准状况)。
22.(14分)从某些方面看,氨和水相当。试回答:
(1)氮可形成多种离子,其中N2H5+ 、N2H62+是由中性分子结合质子形成的(类似NH4+)。
因此有类似于NH4+的性质,试写出N2H62+在强碱性溶液中反应的离子方程式
_____________________________________________________________________。
(2)若液氨相当于地球上的水以满足木星上生物生活的需要,假若那里的生命分子也是以碳链为骨架的话,那么木星上生物体内与地球上生物中葡萄糖的分子结构相当的化合物是 。(写结构简式)。
(3)化学家洛夫特菲尔在20世纪50年代发现α-卤代酮类在碱性催化剂存在时能发生重排反应生成核基,如:

根据上述反应通过合适的步骤可以实现下列转化:
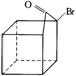 →
→
![]()
A B(立方烷)
①A式的分子式为
②要从A式转化为B式,除先进行上述重排反应后加碱中和之外,还需要进行第三步反应,第三步反应的化学方程式为(用有机结构简式表示)
③对于立方烷B,其一氯代物有 种同分异构体,二氯代物有 种同分异构体,三氯代物有 种同分异构体。
④20世纪80年代中期,美国华裔科学家合成了立方烷的四硝基衍生物,它是一种烈性炸药,四硝基衍生物可有多种同分异构体,但又是一种最稳定的,它就是C,画出C的结构简式: ;C爆炸后能生成两种稳定的单质和两种氧化物,则C爆炸的化学反应方程式是 。
(4)有A、B、C、D、E五种气体,C对空气的相对密度为2.45,在相同温度和压力下,B、D、E的密度之比为4︰2︰1,这五种气体均为常见气体,各气体两两混合时出现如下情况:
| 气体 | A+B | A+E | C+E | D+E | B+C |
| 反应情况 | 不用光照能反应 | 不反应 | 漫射光下反应 | 点燃反应 | 有水存在时易反应 |
据此可以推知:(填化学式)
A ,B ,C ,D ,E 。
|
五、(本题包括2小题,共15分)
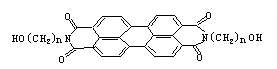
23.(5分)有如下反应ROH+HX![]() RX+H2O。军事上的“地表伪装”是军事上保
RX+H2O。军事上的“地表伪装”是军事上保
护的外观色彩、红外反射与环境吻合。BASF是新型红外伪装还原染料,为橄榄色或黑
色。其化学结构为:
|
(1)染料BASF的分子式 ;
(2)1mol该物质与Na反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,
最大值分别为 , 。
(3)当n=3时,其一氯取代物可能有 种。
(4)和N原子直接相连的C原子 (填能或不能)处于同一平面。
![]() 24.(10分)通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:= C—OH → >C=O +H2O
24.(10分)通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:= C—OH → >C=O +H2O
下面是9种化合物的转变关系:
|
(1)化合物①是_________,它跟氯气发生反应的条件A是______。
(2)化合物⑤跟⑦可在酸的催化作用下去水生成化合物⑨,⑨的结构简式是______,名
称是_________。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它,此反应的化
学反应方程式是____________。
|
三、计算题(14分)
25.(6分)把0.69gNa投入500mL0.1mol/L的AlCl3溶液中,有0.78g白色沉淀生成,再投入多少克Na可使沉淀恰好完全溶解?
26.(8分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为
正整数,且2<b<6,![]() ),有的还含一定数目的结晶水,其组成随反应条件不同而
),有的还含一定数目的结晶水,其组成随反应条件不同而
异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的该
样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量
之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH20(c也是正整数),已知a+b+c=9。
取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P205的U
型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水
的碱式硫酸铜的化学组成。