2003年高三化学月考试题(试验)
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。总分150分,考试时间120分100钟。
第Ⅰ卷(选择题,共74分)
可能用到的相对原子质量:H 1 C 12 O 16 S 32
|
1.有关材料的用途不正确的是 ( )
A.高温结构陶瓷可以制作耐酸设备
B.氧化铝陶瓷不可以用于制耐高温设备
C.氮化硅陶瓷可以制造轴承
D.光导纤维可用于传能、传像照明等
2.“侯德榜制碱法”是将足量CO2通入用NH3饱和的食盐水中,冷却后得某种晶体,用该晶
体可制得纯碱,你认为下列反应正确的是 ( )
A.NaCl+NH3+CO2+H2O====NaHCO3+NH4Cl
B.NaCl+NH3+CO2+H2O====NH4HCO3+NaCl
C.NaCl+NH3+CO2+H2O====Na2CO3+NH4Cl
D.NaCl+NH3+CO2+H2O====(NH4)2CO3+NH4Cl
3.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗
→明,下列说法正确的是 ( )
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.灯泡最暗时溶液中无自由移动的离子
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
4.科学家根据自然界存在的N2制出N3,1998年底又制出N5,这三种物质间的关系为( )
A.同分异构体 B.同位素
C.同素异形体 D.同系物
5.某学生配制硫酸和浓硝酸的混和酸液,将浓硫酸较快地加入到浓硝酸中时,在容器口产
生大量的白雾,跟解释这一现象无关的叙述是 ( )
A.浓硫酸与水作用放出大量的热 B.硝酸具有挥发性
C.硝酸蒸气容易吸收空气中的水蒸气 D. 浓硫酸具有强氧化性
6.废水中糖类(CH2O)n经无氧发酵生成的2种化合物是 ( )
A.C2H2和H2O2 B.CH4和CO2
C.CH3COOH和HCHO D.CO和H2
7.现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所
得溶液的pH接近于 ( )
A.a-lg2 B.b-lg2 C.a+lg2 D.b+lg2
8.烯烃、一氧化碳和氢气在催化剂作用下生成醛的反应,称为羰基合成,也叫烯烃的醛化
反应。由乙烯制丙醛的反应为 ( )
CH2=CH2+CO+H2![]() CH3CH2CHO
CH3CH2CHO
由分子式为C4H8的烯烃进行醛化反应,得到属于醛类的同分异构体可能有
A.2种 B.3种 C.4种 D.5种
|
9.下列合成溴化钾的方法中,最合理的是 ( )
A.KCl![]() KBr B.Br2
KBr B.Br2![]() FeBr3
FeBr3![]() KBr
KBr
C.Br2![]() KBr D.KOH
KBr D.KOH![]() KI
KI![]() KBr
KBr
10.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是 ( )
A.Cl-、Mg2+、NO3—、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42—、Cl-、CO32—、Na+ D.HCO3—、K+、NO3—、SO42—
11.下列离子方程式错误的是 ( )
A.将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O=SO32-+2HClO
B.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.在Ca(H2PO4)2溶液中滴入过量的NaOH溶液
3Ca2++6H2PO4-+12OH-=Ca3(PO4)2↓+4PO43-+12H2O
D.在氟化银溶液中滴入盐酸
Ag++F-+H++Cl-=AgCl↓+HF
12.对于简单反应aA(g)+bB(g)![]() cC(g)(a、b、c为系数),有如下化学反应速
cC(g)(a、b、c为系数),有如下化学反应速
率特征:
V正=k1[A]a[B]b,V逆=k2[C]c,其中k1和k2为只与温度有关的常数。如果缩小反应混合
气体体积到原来的一半,则正反应速率增加到原来的 ( )
A.a倍 B.b倍 C. 2b倍 D. 2a+b倍
13.下列关于Fe(OH)3胶体的说法不正确是 ( )
A.Fe(OH)3溶胶与硅酸溶胶混合,将产生凝聚现象
B.Fe(OH)3胶体粒子在电场影响下将向阳极运动
C.Fe(OH)3胶体微粒滴入MgSO4溶液会出现沉淀
D.往Fe(OH)3胶体中逐滴加入稀H2SO4溶液或稀NaOH溶液时,开始时会出现凝聚,
再继续逐滴加酸液时,沉淀又会消失
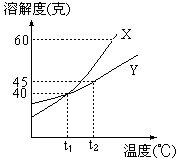 14.X、Y两种物质的溶解度曲线如图:
14.X、Y两种物质的溶解度曲线如图:
①t1℃时,X、Y饱和溶液的质量百分比浓度相等;
②若X晶体中含少量Y晶体,则可用重结晶法提纯X;
③若Y晶体中含有少量X晶体,则可用重结晶法提纯Y晶体;
④将t1℃时的100克X饱和溶液和300克Y饱和溶液分别蒸
发掉20克水,然后温度仍降至t1℃,则Y析出的晶体多;
⑤将t2℃的100克X饱和溶液和100克Y饱和溶液分别从
t2℃降至t1℃时,则析出晶体一样多,以上说法中正确的是
A. ③④⑤ B.①② C.①②④ D.①③⑤
15.将羧酸的碱金属盐电解可生成烃类化合物,例如
|
2CH3COOK+2H2O=====CH3—CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2—COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
![]()
A.电解时两极均有气体产生 B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH D.混合液蒸干后得到的固体物质是KCl
16.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,
经测定Na2O2无剩余,则最后的固体的物质的量为 ( )
A.1~2mol之间 B.1~4mol之间
C.2~4mol之间 D.大于4mol
17.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电
子层结构,B2-具有与Ar相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第Ⅲ族的元素 D.B是第3周期ⅥA族的元素
18.9.8g铁镁混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到0.2molNO
气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量可能
为( )
A.18g B.20g C.22g D.24g
第Ⅱ卷(非选择题,共76分)
|
三、(本题包括2小题,共28分)
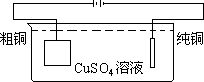 19.(9分)粗铜中除含有铜以外,还有少量锌、铁、银,在
19.(9分)粗铜中除含有铜以外,还有少量锌、铁、银,在
下图的装置中,用纯铜和粗铜分别作为两极进行电解,下
列有关叙述中,正确的是 。
A 可检测到电解液中有锌离子
B 可检测到电解液中有铁离子
C 可检测到电解液中有银离子
D 电解过程中,溶液中的铜离子浓度保持不变
E 在纯铜极上有铜析出
F 在纯铜极上有银析出
G 在纯铜极上有锌析出
H 通电一段时间后,电解池底部会有少量不溶物
I 通电一段时间后,取出两极,称得粗铜极减小的质量等于纯铜极增加的质量
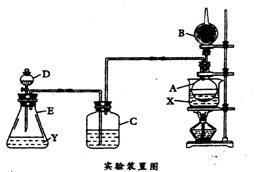 20.(19分)为证明乙醇分子中含有氧原子,现采
20.(19分)为证明乙醇分子中含有氧原子,现采
用一套装置进行实验。试根据以下装置图、试
剂及实验现象,回答有关问题。
![]() Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,
Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,
内放无水盐X;②B干燥管里装生石灰;③C
和D中都装浓硫酸;④E瓶中装入试剂Y
实验操作及现象是:
Ⅱ.用水浴加热A瓶;将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量
气泡放出;A瓶内X逐渐变色,在B管口挥发的气体可点燃。
请回答下列各问题:
(1)E瓶里所装的试剂Y是以下的__________。
a. 饱和食盐水; b. MnO2和NaCl的混合物; c. 浓盐酸
(2)D中浓硫酸所起的作用是_______________________________;C瓶中浓硫酸所起的
作用是__________________________。
(3)A瓶中发生反应的化学方程式是__________________________________;反应类型
是____________;所生成的__________(写名称)在B出口处点燃。
(4)无水盐X宜选用_________,它能起指示作用的原因是_____________________。
(5)此实验能证明乙醇分子中含有氧原子的理由是_______________________
______________________________________________________________。
(6)如果将装置中的C瓶取掉,实验目的是否能达到_________;因为______________
_____________________________________________________________________。
|
四、(本题包括2小题,共15分)
21.(7分)已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质。下表中所
列五种物质都易与水反应。
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式:
| Li3N | ClF | NaNH2 | SiBr4 | Mg2Si |
(2)写出这五种物质与水反应的产物中,溶于水形成无氧酸的物质的电子式:________
22.(8分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分
别为:1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于
水的碱性气体X,B与C能形成极易溶于水的酸性气体Y。X分子与B2A分子中的电子
数相同,Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为B4A3D2,其
水溶液呈弱酸性。请回答:
(1)元素符号A 、B 、C 、D 。
(2)写出化学方程式:C2和X(过量)反应 。
(3)B4A3D2的化学式 ,其水溶液呈酸性的离子方程式 。
(4)液态X能电离(可根据B2A电离推知),其阴离子电子式 。
|
五、(本题包括2小题,共18分)
23.(9分)如图,B为常见金属或非金属单质,有下列转化关系:
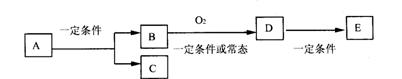
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约
是D物质总质量的25.8%,则A是_________。
②若E是酸酐,且为易挥发的晶体,则A是__________;D转化为E的一定条件是
__________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石
蕊试液变红色。则A是_________;A、B、D、E中易溶于C的物质是_________(填
字母)
24.(9分)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良
好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知: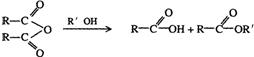
合成路线:
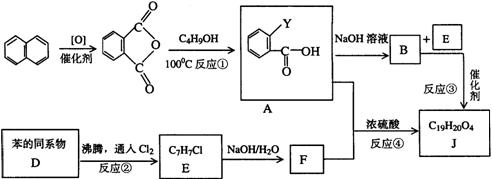
上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② _________反应④__________。
(2)写出结构简式:Y __________ F____________。
(3)写出B+E→J的化学方程式______________。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:________、__________、
___________。
|
25.(6分)C12和NO2在室温下可以化合成一种新的气态化合物C,为了测定C的分子组成,
进行以下实验:取总体积为5L的混合气体,测定反应后气体总体积V随着C12在混合
气体中所占体积分数x的变化而发生变化的规律。实验测知当C12所占体积分数为20%
或60%时,反应后的气体总体积均为4L。
(1)写出反应的化学方程式:__________________________
(2)讨论当x取不同值时,反应后气体总体积V随x变化的函数关系。
26.(9分)某化工设计院承担新科硫酸厂的设计任务,该厂要求:
①为了控制污染和提高生产效率,不再使用黄铁矿,改用固体硫为原料。
②改二次送风(鼓入空气)为一次送风,即送风后使硫充分燃烧,并在下一步催化氧化时
不再补充空气。
③每天生产98%H2SO4 a t。
④送风机每天输送空气的体积为b m3/台(标准状况)。
求:(1)每天消耗纯度为95%的固体硫多少吨?
(2)理论上至少应安装多少台送风机?
(3)固体硫充分燃烧后的混合气体中氧气的体积分数ψ(O2)的下限为多少(转化过程
不考虑损耗;固体硫中杂质与空气不反应;空气中氧气的体积分数为21%)?