高三化学试卷 (7)
可能用到的原子量:
H 1 He 4 C 12 N 14 O 16 Na 23
Mg 24 Al 27 S 32 Cl 35.5 Zn 65
一. 选择题:
1. 在相同的温度和压强下,相同物质的量的氢气和氦气,具有相同的是 ( )
(A) 原子数 (B) 质子数
(C) 中子数 (D) 质量
2. X、Y、Z是3种主族元素。如果X![]() 与Y
与Y![]() 具有相同的电子层结构,Z
具有相同的电子层结构,Z![]() 半径大于Y
半径大于Y![]() 半
半
径,则三种元素的原子序数由大到小的顺序是( )
(A) Z > X > Y (B) X > Y > Z
(C) Z > Y > X (D) X > Z > Y
3. 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
(A) SO2 和SiO2
(B) CO2 和H2O
(C) NaCl 和 HCl
(D) NaOH 和Na2O2
4. X、Y是短周期元素,两者组成化合物X2Y3,已知X的原子序数n,
则Y的原子序数可能为( )
① n+3, ② n+4, ③ n+11, ④ n-6, ⑤ n-5.
(A) ①、③、⑤ (B) ①、②、⑤
(C) ②、④ (D) ③、④
5. 下列物质中,含有非极性键的离子化合物是( )
(A) CaCl2 (B) Na2O2
(C) C2H2 (D) HCOONa
6. 下列各组中的性质比较,正确的是( )
① 酸性:HClO4>HBrO4>HIO4
② 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③ 稳定性:HCl>H2S>PH3
④ 还原性:F![]() > Cl
> Cl![]() >Br
>Br![]()
(A) ①、③、④ (B) ②、③、④
(C) ①、②、③ (D) 都正确
7. 可逆反应 2SO2 + O2 ←→ 2SO3,正反应速度分别用VSO2、VO2、VSO3[摩/(升·分)]
表示,逆反应速度分别用V^^'SO2,V^^'O2,V^^'SO3[摩/(升·分)]表示,当反应达到
化学平衡时,正确的关系是( )
(A) VSO3=V^^'SO3
(B) VO2=VSO2=VSO3
(C) V^^'O2=![]() V^^'SO2
V^^'SO2
(D) V^^'SO2=V^^'SO3=V^^'O2
8. 反应A(气)+xB(气) → yC(气),当A的转化率为50%时,反应前气体的密度是反应后气
体密度的![]() (同温同压),则x与y的数值可能是( )
(同温同压),则x与y的数值可能是( )
①、 3.4 ②、 1.3 ③、 3.3 ④、 1.1
(A) ①、④ (B) ①、③
(C) ②、③ (D) ③、④
9. 漂白粉在溶液中存在下列平衡关系:ClO![]() +H2O → HClO + OH
+H2O → HClO + OH![]() 。
。
下列措施能增强漂白粉的漂白效果是( )
①、 降低温度 ②、 通入CO2气体
③、 加入适量盐酸 ④、 加入适量烧碱溶液
(A) ①、④ (B) ①、③
(C) ②、③ (D) ③、④
10. 在一定温度下,取pH值均为12的NaOH溶液和氨水溶液各10毫升,分别用蒸馏水把两
种溶液都冲稀至1升。关于稀释后的溶液的pH值的说法正确的是( )
(A) NaOH溶液的pH值大于氨水的pH值
(B) NaOH溶液的pH值小于氨水的pH值
(C) 两种溶液的pH值相等
(D) 无法判别两种溶液pH值的相对大小
11. 将10毫升0.1摩/升氨水和12毫升0.1摩/升盐酸混合后,溶液里各种离子的物质的量
浓度由大到小的顺序正确的是( )
(A) Cl![]() >NH
>NH![]() >OH
>OH![]() >H
>H![]()
(B) Cl![]() >NH
>NH![]() >H
>H![]() >OH
>OH![]()
(C) H![]() >OH
>OH![]() >Cl
>Cl![]() >NH
>NH![]()
(D) Cl![]() >H
>H![]() >NH
>NH![]() >OH
>OH![]()
12. 中和相同体积、相同pH值的Ba(OH)2、NaOH 和NH3·H2O三种稀溶液,所用相同浓度
的盐酸的体积分别为V1、V2和V3,则三者关系为( )
(A) V3 > V2 > V1
(B) V3 = V2 > V1
(C) V3 > V2 = V1
(D) V1 = V2 > V3
13. 有一种酸溶液甲和一种碱溶液乙,若将它们等体积混合之后,溶液的pH值大于7,
则下列说法中不正确的是( )
(A) 甲为弱酸,乙为强碱且等体积混合后酸碱完全中和
(B) 甲为强酸,乙为弱碱,且反应前甲溶液中H![]() 和乙溶液中OH
和乙溶液中OH![]() 相等
相等
(C) 甲为一元强酸,乙为二元强碱,且甲、乙溶液的摩尔浓度相等
(D) 甲为弱酸,乙为强碱,且反应前甲溶液的H H![]() 和乙溶液的OH
和乙溶液的OH![]() 相等
相等
14. 某原电池的总反应离子方程式为2Fe![]() +Fe=3Fe
+Fe=3Fe![]() ,不能实现该反应的原电池是( )
,不能实现该反应的原电池是( )
①、 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
②、 正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
③、 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
④、 正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
(A) ①、② (B) ①、③
(C) ②、③ (D) ③、④
15. 用惰性电极和串联电路电解下列物质的溶液:
① HCl ② NaNO3 ③ CuCl2 ④ AgNO3,
在相同时间内生成气体的总体积(相同状况下)在理论上由多到少的顺序是( )
(A) ④、③、②、① (B) ①、②、③、④
(C) ①、③、②、④ (D) ③、④、①、②
16. 下列物质:
① Cl2 ② CO2 ③ Cu ④ AgNO3溶液, ⑤ Fe, ⑥ HCl,
其中能跟FeBr3 溶液反应的是( )
(A) ①、④、⑤、⑥ (B) ②、④、⑤
(C) ①、②、③、⑤ (D) ①、③、④、⑤
17. 朴热息痛是一种优良的解热镇痛剂,它可能具有的化学性质是( )
(A) 不与烧碱溶液反应
(B) 能与浓溴水发生取代反应
(C) 不能被氧化剂氧化
(D) 遇三氯化铁溶液呈现紫色
18. 鉴别下面各组物质,不用任何其它试剂或试纸,也不采取加热的办法而不能实现的是
( )
(A) NaOH溶液和AlCl3溶液
(B) NH3·H2O和AgNO3溶液
(C) 饱和MgCl2溶液和稀NaOH溶液
(D) FeCl3溶液、溴水、硫化钾溶液
19. 13克Zn投入500毫升1摩/升的HNO3溶液中,二者均可反应完全,
下列说法错误的是( )
(A) HNO3中每个N原子都得到4个电子
(B) HNO3的还原产物可能为N2O
(C) HNO3的还原产物可能为HN4NO3
(D) 反应过程中HNO3共得到0.4摩电子
20. 下列离子方程式书写错误的是( )
(A) 硫化亚铁和稀硫酸反应: FeS+2H![]() =Fe
=Fe![]() +H2S↑
+H2S↑
(B) 铁片溶于硫酸铁溶液中: 2Fe![]() +Fe=3Fe
+Fe=3Fe![]()
(C) 氢氧化钡溶液跟稀硫酸反应:Ba![]() +SO
+SO![]() +H
+H![]() +OH
+OH![]() =BaSO4↓+H2O
=BaSO4↓+H2O
(D) 向硝酸铜溶液中通入硫化氢气体:Cu![]() +H2S=CuS↓+2H
+H2S=CuS↓+2H![]()
21. 将乙烯、一氧化碳、氮气3种气体分别盛放在3个容器中,并保持3个容器内气体的温
度和密度均相等,这3种气体对容器壁所施压强的大小关系是( )
(A) C2H4>CO>N2 (B) C2H4= CO = N2
(C) CO>C2H4>N2 (D) N2>C2H4>CO
22. 将m克CaCO3与n克KHCO3分别加入100毫升0.5摩/升盐酸中,若反应后两种溶液的质
量相等,则m与n的关系是( )
(A) m=n,且均≤2.5 (B) m=n,且均>2.5
(C) m=n,且均≥5 (D) m<n<2.5
23. 检验某病人血液中的含钙量,现取10毫升血液样品,稀释后用草酸铵[(NH![]() )
)![]() C
C![]() O
O![]() ]
]
溶液处理成草酸钙沉淀。过滤出此沉淀将其溶于稀硫酸中,然后用0.5摩/升的高锰酸
钾溶液滴定,恰好用去高锰酸钾溶液1.60毫升。题中有关反应的离子方程式为:
Ca![]() + C2O
+ C2O![]() = CaC2O4↓
= CaC2O4↓
CaC2O4
+ 2H![]() = Ca
= Ca![]() + H2C2O4
+ H2C2O4
5H2C2O4
+ 2MnO![]() + 6H
+ 6H![]() = 2Mn
= 2Mn![]() + 10CO2↑+8H2O
+ 10CO2↑+8H2O
则该病人血液中含钙量为( )
(A) 2.4 克/升 (B) 8 克/升
(C) 6 克/升 (D) 12 克/升.
二、分析题和实验题:
1.现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制以少量CuCl2的实验,其实验流程示意
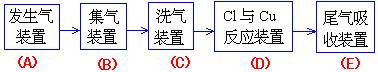 |
如图:(图中“→”表示气体流向。)
(1) B 与C 所需用的仪器是( )
(A)玻璃管 (B) 洗气瓶
(C)干燥管 (D) 酒精灯
B 中应选用的试剂是(水或饱和食盐水).
请判断:( )
C 中选用的试剂的作用是(吸收L2中的水蒸气)。
请判断:( )
(2) 在Cl2和铜粉反应的实验中,根据什么现象判断已有CuCl2生成?
[答]:
(3)E 中应选用的试剂只能从下列物质中选择: ( )
(A) NaBr 溶液 (B) 纯水
(C) KMnO4溶液 (D) Na2SO3溶液
2.根据2KMnO4+10FeSO4+8H2SO4 = 2MnSO4+5Fe2(SO4)3+ K2SO4+8H2O的反应,在实验室里可
以选用与酸碱中和滴定相同的仪器和操作方法,测定绿矾中FeSO4 的百分含量。实验步
骤顺序如下:
① 称取绿矾样品W克,配成100 毫升溶液。
② 取25.0 毫升待测液,置于锥形瓶中,再加入适量H2SO4溶液供滴定使用。
③ 将m 摩/升的标准KMnO4溶液装入滴定管,调节液面该度至a毫升处。
④ 用标准KMnO4 溶液滴定待测液。
⑤ 该实验是用反应物自身颜色变化指示反应终点,到滴定终点时,滴定管内液面的高度为
6毫升。
⑥ 重复滴定操作2~3次。
⑦ 计算。
请根据以上实验步骤填写有关内容。
(1) 实验步骤(1)中,应从下列仪器中选取的是( )
A. 托盘天平(含砝码、镊子) B. 50毫升酸式滴定管 C. 100毫升量筒
D. 100毫升容量瓶 E. 烧杯 F. 胶头滴管 G. 锥形瓶 H. 玻棒 I. V形纸槽 J. 药匙
(A) A、D、E、F、G (B) B、D、F、H、J
(C) A、D、E、F、H、J (D) A、D、F、G、H
(2) 不能用( 碱)式滴定管盛放KMnO4 溶液。
请判断:( )
(3) 锥形瓶用蒸馏水洗净的标志是(瓶内壁不挂水珠,不成股流下).
请判断:( )
若锥形瓶未干燥,对实验结果( )
(填1---“偏高”、2---“偏低”、3---“无影响”)
(4) 滴定时,两眼应注视锥形瓶的溶液颜色的变化;达到滴定终点的标志是
(KMnO4 溶液滴入后不再褪色).
请判断:( )
3.某化学兴趣小组在空气中加热硫粉与铁粉的混和物制取FeS, 现有浓H2SO4、浓HNO3、稀HCl、稀HNO3、FeCl3溶液、NH4SCN 溶液及氨水。简述用最简便可靠的实验方法检验残余固体中是否含有少许Fe2O3.
[答]:
三、
1.用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含有少量CaO、Fe2O3)研制新型净水剂(铝
的化合物)。
其实验步骤如下:
将土样和纯碱混匀,加热熔融,冷却后用水浸泡熔块,过滤,弃去残渣。滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂。
(1) 写出熔融时主要成分与纯碱的反应方程式?
[答]:
(2) 最后的沉淀物是( H2SiO3 ), 生成该沉淀的离子方程式是:
SiO![]() + 2H
+ 2H![]() = H2SiO3 ↓
= H2SiO3 ↓
请判断:( )
(3) 实验室中常用的有瓷坩埚、氧化铝坩埚和铁坩锅,本实验在熔融土样时,
应选用( )坩埚。
(A) 瓷坩埚 (B) 氧化铝坩埚
(C) 铁坩锅 (D) 以上都不对。
2.一包质量为 23.24 克的粉末,它是由NaCl、CuSO4、Na2O2、(NH4)2SO4、Na2SO4、KNO3等
7 种物质中的某几种混和而成。
(a) 将粉末全部投入足量蒸馏水中,得无色溶液和气体,加热使反应完全,收集到的气体
干燥后体积共为3.36升(标准状况);
(b) 将所得溶液分成两等份。一份中滴入酚酞试液,呈现红色,用浓度为4摩/升的盐酸中
和消耗12.5毫升;
(c) 向另一份中加稀硝酸酸化,无气体产生,加入过量Ba(NO3)2溶液,得到白色沉淀,
经过滤干燥,质量为12.815克,滤液中加入AgNO3溶液无现象;
(d) 所得的3.36升气体通过浓H2SO4,体积明显减少;再通过碱石灰,体积不改变。
请根据以上实验现象和数据,分析并确定该粉末由哪些物质组成?
质量各是多少克?
[答]:
参 考 答 案
一、
1. B 2. A 3. B 4. A 5. B 6. C 7. A 8. C
9. C 10. B 11. B 12. C 13. D 14. D 15. B 16. D
17. D 18. C 19. A 20. C 21. B 22. A
23. B
二、
1.
(1) B; 对; 对
(2)[答]:看到的现象是:管内固体呈红热状,生成棕黄色烟。
(3) D
[分析]: 其理由是因反应Na2SO3 + CL2 + H2O = Na2SO4 + 2HCL , 可以吸收CL2.
2.
(1) C
(2) 对
[分析]:其原因是KMnO4 易氧化碱式滴定管中的橡胶管而使仪器损坏。
(3) 对 ( 3 )
(4) 对
3.[答]:取少量残余固体,加入足量的盐酸后,再滴入KSCN溶液,如果溶液变红,
证明有Fe2O3,如果溶液不褪色,证明不含Fe2O3 。
三、
1.
(1) [答]: SiO2 + Na2CO3 = Na2SiO3 + CO2 ↑
AL2O3 + Na2CO3 = 2NaALO2 + CO2↑
(2) 对
(3) C
2.[答]: 由(a)可知,原固体不含CuSO4,含有Na2O2和(NH4)2SO4因溶于水中后溶液呈无色,生成气体,即反应为:2Na2O2 + 2H2O = 4NaOH + O2↑
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑ + 2H2O
由(b)可知,反应后溶液中剩余NaOH 为:4×12.5×10![]() ×2=0.1(摩尔)。
×2=0.1(摩尔)。
由(c)可知,原固体不含K2SO4和NaCL,而可能含有Na2SO4,故反应为:
Ba![]() + SO
+ SO![]() = BaSO4↓
= BaSO4↓
设原固体中含有Na2O2 为x克,生成NaOH y摩尔,O2z升,
2Na2O2 + 2H2O = 4NaOH + O2↑
2×78克 4摩尔 22.4升
x克 y z
解出:![]() (摩尔)
(摩尔) ![]() (升)
(升)
所以与(NH4)2SO4 反应的 NaOH 物质的量为:![]() (摩)
(摩)
又由: (NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑+ 2H2O
1 摩尔 2 摩尔 2 摩尔
所以原固体中含有(NH4)2SO4 为:![]()
![]()
解方程得: x=7.8 (克)
则O2 的体积为 =![]() (升),
(升),
NH3 的体积为=3.36-1.12 = 2.24 升,合0.1摩尔。
由关系式:
(NH4)2SO4 —— 2NH3↑,可知原固体含(NH4)2SO4为132×![]() =6.6克
=6.6克
又因为生成的BaSO4 物质的量=![]() 摩尔
摩尔
所以原固体含Na2SO4:
0.11-![]() = 0.06 摩,质量为: 142×0.06=8.52克
= 0.06 摩,质量为: 142×0.06=8.52克
23.24 - 7.8 - 6.6 - 8.52 = 0.32 (克), 为KNO3的质量.