南京市07届上学期高三教学质量检测考试
化学试卷
总分150分
一、单选题(8小题×4分)
1.下列物质属于天然高分子化合物的是
A.聚氯乙烯 B.尼龙 C.油脂 D.纤维素
2.下列关于某些社会热点问题的说法中,不正确的是
A.光化学烟雾的产生与碳氢化合物、氮氧化合物的排放有关
B.禁止使用含铅汽油是为了提高汽油的燃烧率
C.臭氧空洞的形成与氟氯烃或氮氧化物的泄漏到大气中有关
D.甲醛是某些劣质装饰板材释放的常见污染物之一
3.近代化学常用CaH2作生氢剂,其化学方程式为:CaH2 + 2H2O = Ca(OH)2 + 2H2↑,其中水的作用是
A.氧化剂 B.还原剂 C.溶剂 D.既是氧化剂又是还原剂
4.已知H2(g) + Cl2(g) = 2HCl(g);△H = —184.6 kJ·mol-1 ,则反应HCl(g) = H2(g) + Cl2(g)的△H为
A. + 184.6 kJ·mol-1 B.— 92.3 kJ·mol-1
C.+ 92.3 kJ·mol-1 D.— 369.2 kJ·mol-1
5.下列实验方案合理的是
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸、乙醇杂质
B.用加入浓溴水的方法分离甲苯和苯酚的混合液
C.用点燃的方法来除去二氧化碳中混有的少量一氧化碳
D.用过滤的方法除去苯酚中的三溴苯酚
6.阿佛加德罗常数约为6.02×1023·mol-1,下列说法中正确的是
A.标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023
B.1 mol MgCl2中含有的离子数约为2×6.02×1023
C.1.8g的NH4+离子中含有的电子数约为6.02×1023
D.2.4g金属镁变为镁离子时失去的电子数约为0.1×6.02×1023
7.下列离子方程式中,正确的是
A.在氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Cl-
B.三氯化铁溶液跟过量氨水反应:Fe3+ + 3NH3·H2O = Fe(OH)3↓+ 3NH4+
C.碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.偏铝酸钠的水溶液显碱性:AlO2- + 2H2O
![]() Al(OH)3↓+ OH-
Al(OH)3↓+ OH-
8.常温下,测得某无色溶液中由水电离出的C(H+) = 1×10-13 mol·L-1,则该溶液中一定能共存的离子组是
A.AlO2-、NO3-、Na+、Cl- B.Mg2+、SO42-、Na+、ClO-
C.Fe3+、NO3-、K+、SO42- D.Ba2+、K+、NO3-、Cl-
二、多选题(8小题×4分)
9.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是
A.碳酸钠溶液中滴加稀硫酸 B.氯化铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.酸性高锰酸钾溶液中滴加亚硫酸钠溶液
10.25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是
A.HA溶液的pH一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1
D.混合后溶液中,c(M+)一定等于c(A-)
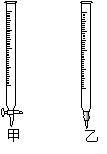 11.用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度,滴定管如图甲、乙所示。从下表中选出的正确的是组合是
11.用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度,滴定管如图甲、乙所示。从下表中选出的正确的是组合是
| 锥型瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |
12.如图:一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH溶液。负极的反应式为:Zn - 2e- + 2OH- = ZnO + H2O,该电池总反应式为:Zn + Ag2O = ZnO + 2Ag。根据以上提供的资料,判断下列说法正确的是
A.正极的反应式为:Ag2O + 2e- + H2O = 2Ag + 2OH-
B.放电时负极附近溶液的pH不变
C.放电时每消耗6.5gZn,转移电子0.1mol
D.放电时溶液中阴离子向正极方向移动,阳离子向负极方向移动
13.下列叙述正确的是
A.分子晶体中都存在共价键
B.F2、Cl2、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性共价键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
14.2006年3月2日英国《泰晤士报》报道指出:汽水 中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯。下列说法不正确的是
A.苯是非极性分子
B.苯在一定条件下能发生取代反应和加成反应
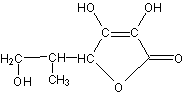 C.维生素C在碱性溶液中能稳定存在
C.维生素C在碱性溶液中能稳定存在
D.维生素C可溶于水
15.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
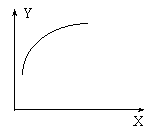 2A(g) + B(g)
2A(g) + B(g) ![]() 2C(g) ;
△H < 0 达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g) ;
△H < 0 达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 缩小体积 | A的转化率 |
| D | 升高温度 |
|
16.含8.0gNaOH的溶液中通入一定量H2S后,将得到的溶液低温小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
三、(本小题包括2小题,共22分)
17.(7分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
⑴ 甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:___________(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是__________。
⑵ 现提供以下试剂:
A.酸性高锰酸钾 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
根据所学知识判断,________同学(填甲或乙)的推断是正确的。用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
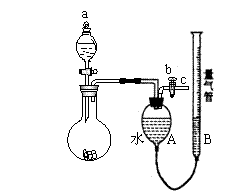
18.(15分)某校课外实验小组同学设计了如图所示的实验装置进行实验(夹持装置已略去)。
⑴ 该小组同学用该装置进行“乙炔的制取及其燃烧性质的验证”实验。① 仪器a的名称是____________,实验开始时使用该仪器的操作方法是______________________。
② 点燃乙炔前,需要验纯。简述验纯的操作方法:_______________________。
③ 在导管口c处点燃乙炔,观察到的现象是______________________________。
⑵ 该装置还可用于制取并收集少量其他气体。请帮助该小组同学完成下表。
| 制取气体 | 药品 | 化学方程式 |
| O2 | _______、_________ | _____________________ |
| ____ | NaOH浓溶液、Al | _____________________ |
⑶ 某同学用该装置进行实验,确定某饱和醇的结构。反应前,先对量气管进行第一次读数;反应后,待装置温度冷却到室温,再对量气装置进行第二次读数(表中读数已折合成标准状况下的数值)。实验数值如下:
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62 g | 5.0 g(足量) | 40 mL | 264 mL |
| ② | 0.31 g | 2.5 g (足量) | 40 mL | 152 mL |
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇的结构式为______________ 。
 |
四、(本题包括两小题,共19分)
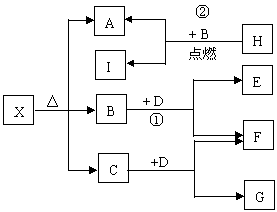
19.(9分)已知X是一种盐,H是常见金属单质,
F、I是常见非金属单质,E、G都是工业上重
要的碱性物质,它们有右图所示的关系。
试回答下列问题:
⑴ G的化学式为______________
⑵ 写出下列反应的化学方程式
① ___________________________
② ___________________________
⑶ X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3 : 8,则X的化学式为_____________;X与盐酸反应的化学方程式为____________________________。
20.(10分)发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴ 写出N2的电子式________________
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为________________________
⑶ 25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度___________(填“大于”、“等于”或“小于”)0.1 mol·L-1 NaOH水溶液中水的电离程度。若将0.1 mol·L-1 NaOH和0.2 mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为__________________________________。
⑷ 在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4 + H3O+
![]() N2H5+ +
H2O
N2H4 + H2O
N2H5+ +
H2O
N2H4 + H2O ![]() N2H5+ + OH-
N2H5+ + OH-
N2H5+ + H2O ![]() N2H62+ + OH- N2H5+
+ H2O
N2H62+ + OH- N2H5+
+ H2O ![]() N2H4 + H3O+
N2H4 + H3O+
据此可得出的结论是_______________
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
⑸ 完成下列反应方程式并配平:
__NH3 + ___NaClO == ___NaCl + ___N2H4 + ___ ___________
⑹ 发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4 gN2H4(g)上述反应中放出71kJ的热量,写出该反应的热化学方程式
___________________________________________________________
五、(本题包括1小题,共9分)
21.工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。启东市近期一次的“空气质量日报”显示,启东的空气已受到一定程度的污染。一研究性学习小组对启东市的空气污染情况进行了下列研究。
⑴ 小组一同学初步分析得出,启东市空气污染的主要原因有:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成启东市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
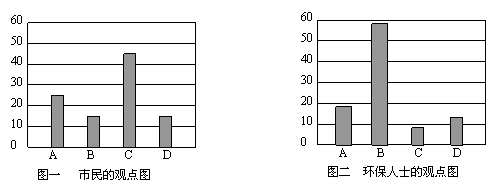 空气污染原因调查人数分布图
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
(用化学式表示)
⑵ 空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶ 研究性学习小组取相当于标准状况下的空气10.0L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.0233g,试回答回答白色沉淀的化学式是_________,c通过计算得该空气中主要有害气体成分的体积分数为 。
⑷ 该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是 (填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
 六、(本题包括2小题,共18分)
六、(本题包括2小题,共18分)
22.(7分) L—多巴是一种有机物,它可用于帕金森综合症,其分子式为 C9H11O4N。这种药物的研制是基于获得2000年诺贝尔生理学奖和获得2001年诺贝尔奖的研究成果。已知含碳、氢、氧、氮4种元素的有机物在空气中完全燃烧生成二氧化碳、水和氨气。
⑴ L—多巴分子在空气中燃烧的化学方程式是__________________________
⑵ 若烃C7H12和C5H12的混合物1mol在空气中完全燃烧时消耗的氧气为9mol,则混合物中C7H12和C5H12的质量比为_______________
⑶ 若某烃的含氧衍生物0.1mol在空气中完全燃烧时消耗的氧气的物质的量与等物质的量的L—多巴分子完全燃烧时消耗的氧气相同,且生成二氧化碳17.92L(标准状况),则该烃的含氧衍生物通式为______________(用含n的化学式表达)
23.(11分)萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)
⑴ 根据右图写出萨罗的结构简式_______________
⑵ 萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请回答同时符合下列四个要求的水杨酸的同分异构体共有_________种。
① 含有苯环;②能发生银镜反应,不能发生水解反应;③ 在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;④ 苯环上只能生成两种一氯代物。
⑶ 从⑵确定的同分异构体中任选一种,指定为下列框图中的A。
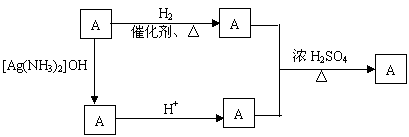 |
已知E中含有14个碳原子。写出下列两个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
① A ![]() B
_______________________________________________
B
_______________________________________________
② B
+ D ![]() E
_____________________________________________
E
_____________________________________________
七、(本题包括2小题,共18分)
24.(8分)在某浓度的氯化钡溶液V mL中,加入一定体积、物质的量浓度为0.0500mol·L-1的稀硫酸时,两者恰好完全反应,此时溶液的pH = 3 。
试求:⑴ 加入稀硫酸的体积(用含V的数学式表达,两溶液混合时体积变化忽略不计)。
⑵ 原氯化钡溶液的物质的量浓度。
25.(10分)碳酸氢铵和熟石灰共热时可能发生如下反应:
NH4HCO3 + Ca(OH)2 ![]() CaCO3 + NH3↓+
2H2O
CaCO3 + NH3↓+
2H2O
NH4HCO3 ![]() NH3↑+
CO2↑+ H2O
NH3↑+
CO2↑+ H2O
取碳酸氢铵和熟石灰的混合物共0.1mol,在密闭容器中加热至200℃(200℃时CaCO3、Ca(OH)2不分解),充分反应后,排出多余气体,冷却后称量,固体剩余物质量为a g。
⑴ 若碳酸氢铵和熟石灰以等物质的量混合时,a = _____________ g。
⑵ 若以b mol表示混合物中碳酸氢铵的物质的量,通过计算确定a随b变化的数学表达式。
参考答案
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | B | A | C | A | C | B | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | BD | CD | A | B | C | AC | A |
三、
17、⑴ Br2 ⑵ 乙
| 选用试剂 | 实验现象 | |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
18、⑴ ① 分液漏斗;先打开塞子或将小孔对齐,再打开活塞
② 收集一试管气体,用拇指堵住试管口移近火焰点燃,若有轻微的响声,证明气体较纯。
③ 火焰明亮并伴有浓烈的黑烟
⑵
⑶ (乙二醇的结构式)
四、
19、⑴ NaOH;
⑵ ①
2Na2O2 + 2CO2 ![]() 2Na2CO3 + O2;②
2Mg + CO2
2Na2CO3 + O2;②
2Mg + CO2 ![]() 2MgO + C
2MgO + C
⑶ 3MgCO3·Mg(OH)2 或 Mg4(OH)2(CO3)3
3MgCO3·Mg(OH)2 + 8HCl = 4MgCl2 + 3CO2↑ + 4H2O
20、⑴
⑵ 2NH3 ![]() NH4+ + NH2
NH4+ + NH2
⑶ 大于;c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
⑷ C
⑸ 2NH3 + NaClO = N2H4 + NaCl + H2O
⑹ N2H4(g) + NO2(g) = N2(g) + 2H2O(g);△H = — 568 kJ·mol-1
21、⑴ 机动车辆的尾气
⑵ 雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
⑶ BaSO4 0.0224%
⑷ ①②④
22、⑴ C9H11O4N + 9O2 ![]() 9CO2
+ 4H2O + NH3
9CO2
+ 4H2O + NH3
⑵ 4 : 3
⑶ C8H4(H2O)n 或 C8H2n+4On (n为小于8的整数)
23、
24、⑴ X = mL ⑵ Y = 5.05 × 10-4 mol·L-1
25、⑴ 5
⑵ 当 0< b < 0.05时,a = 7.4 - 48b
当0.05 ≤ b < 0.1时,a = 100(0.1 - b)