2006届从化五中一模考前化学综合试题
可能用到的原子量:C 12 H 1 O 16 N 14 S 32 Fe 56 Mg 24 Na 23
Ba 137 Cr 52 Na 23 Al 27
第一部分 选择题(共67分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.消毒剂在日常生活、医疗、卫生、防疫中都有重要的作用,下列消毒剂的使用不正确的是
A.过氧乙酸、漂白精是常用的消毒液
B.食品加工、消毒防腐常使用福尔马林
C.因患禽流感而被隔离的地区,常用生石灰处理
D.医疗上常用75%的酒精进行消毒
2.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A .SO2 B.白色沉淀物 C.Fe3+ D.HNO3
 3.对同样的反应物若使用不同的催化剂,可得到不同的产物 。如:
3.对同样的反应物若使用不同的催化剂,可得到不同的产物 。如:
C2H5OH CH3CHO + H2↑
2C2H5OH CH2=CHCH=CH2 + H2↑ + 2H20
2C2H5OH C2H5OC2H5 + H2O
又知C2H5OH在活性铜催化作用下,可生成CH3COOC2H5 及其它产物,则其它产物可能为
A.H2 B.CO2 C.H2O D.H2和H2O
4.反应4A(g)+ 5B(g)![]() 4C(g)+ 6D(g) 在0.50 L密闭容器中进行反应,半分钟后,A 减少了0.90 mol,则此反应的反应速率可表示为
4C(g)+ 6D(g) 在0.50 L密闭容器中进行反应,半分钟后,A 减少了0.90 mol,则此反应的反应速率可表示为
A. v(A)=3.6mol∙L-1∙S-1 B. v(B)=0.075mol∙L-1∙S-1
C. v(C)=0.030mol∙L-1∙S-1 D. v(D)=0.060mol∙L-1∙S-1
5.下列4组溶液,不用试剂也能鉴别开来的是
① AgNO3溶液、稀氨水 ② NaAlO2溶液和盐酸
③ NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl ④ NaNO3、FeCl3、NaCl、AgNO3
A.只有① B.①② C.①②③ D.全部
6. 将30℃物质A的溶液136 g分成两份,向其中一份加入10 g A,结果只溶解了2 g 就不再溶解; 将另一份溶液降温至0℃,析出A 5.5 g,此时溶液中A的质量分数是20%(已知A中不含结晶水,则A在30℃时的溶解度为
A.40g B.30g C.22g D.20g
7.下列说法可以实现的是:①酸性氧化物均能与碱发生反应,②弱酸盐溶液与酸反应以生成强酸,③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,④两种 酸溶液充分反应后,所得溶液呈中性,⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④⑤ B.①③④⑤ C.①②③⑤ D.①②③④⑤
8.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
9.A和B是第二或第三周期元素,可在同一周期,也可以在不同周期,两者可形成AmBn型离子化合物,若A的原子序数为x,则B的原子序数不可能是
A.x-m-n+16 B.x+m+n-8 C.x-m-n+8 D.x-m-n
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要错选一个,该小题为0分)
10. 下列离子方程式中正确的是
A.在次氯酸钡溶液中加入足量的SO2气体
Ba2+ + 2SO2 +2ClO- + 2H2O = BaSO4↓+SO42- + 4H+ + 2Cl-
B.镁粉溶于氯化铵溶液 Mg +2NH4++2H2O = Mg2+ +2NH3∙H2O
C.过氧化钠和水反应 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D.硫化钠溶液和硫酸铝溶液混合 3S2- +2Al3+ = Al2S3↓
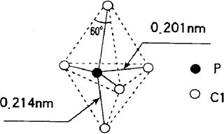 11.第VA族元素的原子(以R表示)与A原子结合形成RA3气态分子,其空间构型呈三角锥形。PCl5 在气态和液态时,分子结构如图所示,下列关于PCl5 分子的说法中不正确的是
11.第VA族元素的原子(以R表示)与A原子结合形成RA3气态分子,其空间构型呈三角锥形。PCl5 在气态和液态时,分子结构如图所示,下列关于PCl5 分子的说法中不正确的是
A.每个原子都达到 8 电子稳定结构
B.键角(∠ClPCl)有90o、120o、180o几种
C.PCl5 受热后会分解生成分子空间构型
呈三角锥形的 PCl3
D.分子中5个P—Cl 键键能不都相同
12.已知在酸性条件下有反应,2Cu+═Cu2+ + Cu 氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O 。某学生对某次氢气还原氧化铜实验产物做了如下实验,实验操作和实验现象列表如下:
| 加入试剂 | 稀硫酸 | 浓硫酸并加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体 蓝色溶液 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验产物
A.是Cu B.是Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
13.元素X、Y在周期表中处于相邻周期,这两种元素原子的核电荷数之和为21,Y原子核外电子数比X原子核外电子数多5,则下列叙述中正确的是
A.Y单质在空气中可以燃烧生成含YX元素的化合物
B.氢元素与X、Y三种元素组成的化合物在水中存在着两种电离方式
C.含Y与X 两种元素组成的阴离子的溶液,与酸反应时,实验操作顺序不同实验现象也不相同
D.Y与强酸或强碱溶液反应时,都生成Y的阳离子
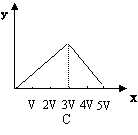
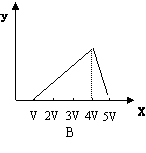 14.将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的物质的量(y)的关系示意图正确的是
14.将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的物质的量(y)的关系示意图正确的是

 | |||
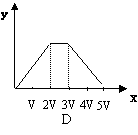 | |||
15.下列溶液中各离子浓度的大小顺序正确的是
A.0.1 mol∙L-1的NH4Cl溶液与0.05 mol∙L-1NaOH溶液等体积混合
c(Cl-)> c(NH4+)>c(Na+)>c(OH-)> c(H+)
B.0.2 mol∙L-1 Na2CO3溶液 c(OH-)=c(HCO3-)+ c(H+)+2c(H2CO3)
C.0.1 mol∙L-1的(NH4)2SO4溶液 c(SO42-)>c(NH4+)> c(H+)>c(OH-)
D.0.2 mol∙L-1 NaHCO3溶液 c(Na+)> c(HCO3-)> c(CO32-)>c(OH-)
16.向1 mol赤热的Cu2S通入足量水蒸气,生成2 mol H2,则Cu2S应转化成
A.Cu和SO2 B.Cu和S C.CuO和SO2 D.CuO和S
17. 不能反映反应2A(g)+B(g)![]() 2C(g) ; △H<0 的有关变化的图象是( )
2C(g) ; △H<0 的有关变化的图象是( )
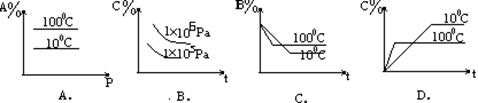
18.以M原子为中心形成的MX2Y2分子中,X、Y分别只以单键与M结合,
下列说法正确的是
A.若MX2Y2分子为平面四边形则无同分异构体
B.若MX2Y2分子为平面四边形就有两种同分异构体
C.若MX2Y2分子为四面体形则无同分异构体
D.若MX2Y2分子为四面体形就有两种同分异构体
19. 向2mL 0.5mol·![]() 的
的![]() 溶液中加入3mL 5mol·
溶液中加入3mL 5mol·![]() KF溶液,发现
KF溶液,发现![]() 溶液渐渐褪至无色,再加入KI溶液和
溶液渐渐褪至无色,再加入KI溶液和![]() 振荡后,静置,不见
振荡后,静置,不见![]() 层有紫红色,则下列说法正确的是( )
层有紫红色,则下列说法正确的是( )
A.![]() 不与
不与![]() 发生反应 B.
发生反应 B.![]() 与
与![]() 结合成不与
结合成不与![]() 反应的物质
反应的物质
C.F-使![]() 的还原性减弱 D.
的还原性减弱 D.![]() 被F-还原为
被F-还原为![]() ,使溶液中不再存在
,使溶液中不再存在![]()
第二部分 非选择题(共83分)
三.(本题包括2小题共21分)
20.(8分)(1)某学生的实验报告中有下列数据:
①用托盘天平称取11.7 g氯化钠; ②用100 mL的量筒量取21.48 mL盐酸;
③用容量瓶配制480 mL 1 mol/L的氯化钠溶液;
④用酸式滴定管量取25.00 mL硫酸溶液;
⑤用pH试纸测定H2SO4溶液的pH为3.2。其中合理的是
A.只有①④ B.只有②④ C.只有①③ D.只有②⑤
(2)向鸡蛋白水溶液中加入少量的 (填一种试剂),再 (填实验操作名称)可得到较纯的鸡蛋白固体
(3)鉴别苯、苯酚、1-己烯、四氯化碳、碘化钠溶液,应选用的试剂是
21.(13分)某化学兴趣小组的同学受带火星的木条分别在空气和O2中的现象区别的启发,设计了对NO2气体能否支持燃烧的实验方案
(1)甲组同学设计的实验方案为:向烧瓶中加入适量的浓硝酸并加热,当烧瓶中有红棕色气体产生后,将带火星的木条伸入烧瓶中,发现木条熄灭,由此他们得出NO2不能支持燃烧的结论,甲组同学所得出的结论一定正确吗?请你说明理由
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,如2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ ; 2AgNO3 = 2Ag + 2NO2↑ + O2↑
他们根据此原理设计了如下图的装置(加热、夹持仪器未画出)并分别用Cu(NO3)2、
 AgNO3进行实验,
AgNO3进行实验,
试验中发现,当红棕色的气体进入集气瓶后,带火的木炭均能复燃,
乙组同学由此得出NO2能支持燃烧的结论,指导老师认为乙组的两实验中,有
一个实验所得结论是不可靠的,你认为该实验中所选用的反应物是
结论不可靠的原因是 ;运用该实验装置进行实验的缺陷是
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2)来探究NO2能否支持燃烧的实验。
丙组同学制取NO2的化学方程式是
下图是该组同学设计的制取并收集较纯净的NO2气体的实验装置,请在方框图中将该
装置补充完整,并注明补充装置中所用的试剂及用量。
 |
四.(本题包括3小题共27分)
22.(9分)有常见A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:
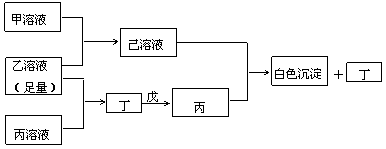 |
(1)写出C元素的原子结构示意图
(2)用离子方程式解释乙溶液呈酸性的原因 ;丙溶液呈碱性的原因
(3)写出下列反应的离子方程式:
①少量的丙溶液滴加到乙溶液中 ②己溶液+丙溶液→丁
23.(10分)金属镁与镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3·MgCO3)为原料,经高温煅烧生成氧化物(CaO·MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷凝为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
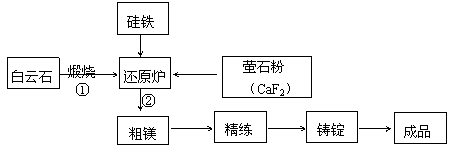 |
(1)在冶炼过程中反应温度对生成金属镁的影响如图:
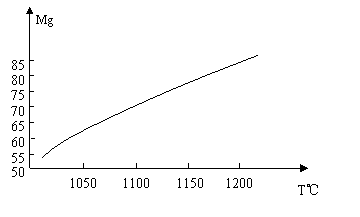 |
从图中分析,还原反应的反应热△H 0(填“<” “>” “=” )
理由是
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系
如下
| 剩余压强mmHg | 760 | 10 | 1 | 0.1 |
| 平衡时的温度℃ | 2370 | 1700 | 1430 | 1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl·MgCl2·6H2O)其中KCl·MgCl2·6H2O属于
(4)写出下列反应的方程式
①煅烧白云石
②CaO·MgO与Si的反应
24.(8分)
(1)室温下,将2 g 苯(C6H6)完全燃烧生成液态水和CO2,放出83.6 kJ的热量,
写出C6H6燃烧的热化学方程式
。
(2)若l g水蒸汽转化成液态水放热2.44 kJ,则室温下C6H6完全燃烧生成1 mol水蒸气时的反应热为 。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气,
构成燃料电池,则通入甲烷气体的极是原电池的 ,
该极的电极反应是 ,
电池工作时的总反应的离子方程式是 。
五、(本题包括2小题共20分)
25.(8分) (1)相对分子质量为84的烯烃,主链上有4个碳原子,可能有 种结构式,分别写出它们结构简式中的任意两种 符合上述条件的烯烃中与H2加成后的产物其一氯代物只有2种,写出其中任意一种一氯代物的名称 和对应的结构简式
(2)已知某碳氢化合物A的分子式中:①有六个碳原子;②每个碳原子都以3个键长相等的单键分别跟其它3个碳原子相连,形成2个90∘的碳─碳─碳键角和一个60∘的碳─碳─碳键角。
根据以上事实判断A的分子中 (填“有”或“没有”)碳碳双键,A的结构可以表示为 (只要求写出碳架,不要求写出C、H符号)。
26. (12分)已知有机物分子中的烯键可发生臭氧化分解反应,例如:
有机物A的分子式是C20H26O6,它可以在一定条件下发生缩聚反应合成一种感光性高分子B,B在微电子工业上作光刻胶。
有机物A的部分性质如下图所示:
 |
试根据上述信息结合所学知识,回答:
(1) 化合物A、C、E中,具有酯的结构的是
(2) 写出下列化合物的结构简式:
C: ,D: ,E: ,B:
(3) 写出反应类型:
反应Ⅱ ,反应Ⅲ 。
(4) 写出反应Ⅱ的化学方程式(有机物要写结构简式):
六、(本题包括2小题,共15分)
27.(5分)
在恒温时,向某密闭容器中通入2 mol X和 1 mol Y气体,发生如下反应:
2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
(l)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和 2 mol Y(g),
达到平衡,则Z的体积分数为_____________;
平衡时,气体X的体积分数为是_____________。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和 Y(g)的物质的量分别记为 n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则![]() 的取值范围为______________。
的取值范围为______________。
28.(10分)六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH) 3沉淀.其主要反应的化学方程式如下:
H2Cr2O7+ 6FeSO4+ 6H2SO4 ═ 3Fe2(SO4)3 + Cr2(SO4)3 + 7H2O
(1)现取某地区含铬废水250 mL,分别取出3份,每份25.00mL用0.005625 mol∙L-1 FeSO4溶液滴定,分别用去19.98 mL,20.02 mL 和22.08 mL FeSO4溶液。则该地区每升含铬废水中含铬的质量为多少m g
用上法处理1×104升含铬(+6价)的废水,试回答:
(2)处理后,沉淀物中除Cr(OH)3 外, 还有 、 (用化学式表示).
(3)需用绿矾多少千克?
2006届从化五中一模考前化学综合试题答题卷
高三( )班 号 姓名 成绩
一、二、选择题
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| 答案 |
| |||||||||
| 题序 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
|

|
2006届从化五中一模考前化学综合试题试题参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| B | D | A | B | D | A | D | C | B | |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| AC | A | D | BC | A | AB | A | A | BC | B |
20.(8分)(1)A. (2分) (2)饱和(NH4)2SO4溶液,(2分)过滤、洗涤(2分)
(3)浓溴水(2分)
21.(共13分)(1)不一定正确,(1分)因为加热时HNO3分解产生的水(1分)及溶液中蒸发出来的水蒸汽可能导致木条熄灭。(1分)(共3分)
(2)AgNO3、(1分)AgNO3受热产生的混合气体中O2的体积分数为1/3大于空气中O2的体积分数,(1分)所以木条的燃烧可能是由于集气瓶中O2浓度增大所致,(1分)
没有尾气的吸收装置,会使产生的NO2污染空气(1分)
(3)Cu + 4HNO3 ═ Cu(NO3)2 + 2 NO2 ↑ + 2H2O (2分)

浓硫酸(1分)NaOH溶液(1分)导气管的长短(1分)液面的高度(1分)
 22.(1)写出C元素的原子结构示意图 (1分)
22.(1)写出C元素的原子结构示意图 (1分)
(2)NaHSO4=Na+ +H+ +SO42-;(2分)
CO32- +H20 ![]() HCO3- + OH- (2分)
HCO3- + OH- (2分)
(3)写出有关反应的离子方程式
①2H+ + CO32- ═ CO2↑+ H20 (2分)
② 2Al3+ +3 CO32- +3H20═2Al(OH)3↓ +3 CO2↑ (2分)
23.(10分)(1)△H > 0 (1分),升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应 (2分)
(2)① 降低反应所需的温度,节约能源(1分) ② 防止Mg被空气氧化 ,(1分)
(3)属于 复盐 (1分)
|
|
②CaO·MgO与Si的反应 2CaO·MgO + Si ═ Mg↑ + 2CaO·SiO2 (2分)
24.(8分)
![]() 24.(1)C6H6(1)+15/2O2(g) 3H2O(l)+6CO2(g);△H=-3260.4kJ/mol(2分)
24.(1)C6H6(1)+15/2O2(g) 3H2O(l)+6CO2(g);△H=-3260.4kJ/mol(2分)
(2)△H=-1042.8kJ/mol。(1分)
(3)负极(1分) ,CH4+10OH--8e-=CO32-+7H2O (2分)
CH4+2O2+2OH-→ CO32-+3H2O(2分)
五、(本题包括2小题共22分)
25.(8分) 4 (1分)
![]()
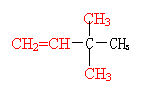
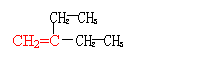
|
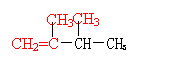
(任意两种各1分)
1-氯-2,3-二甲基丁烷 (或 2-氯-2,3-二甲基丁烷)及对应的结构简式 (各1分)
(2)没有(1分) (2分)
 26.
(共12分)(1)A (1分)
26.
(共12分)(1)A (1分)
(2)C:OHC—CHO (1分) D: (2分)
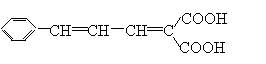 |
E:
(2分)
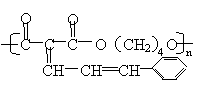 |
B (2分)
(3)反应Ⅱ 取代 ,反应Ⅲ 加成 (各1分)
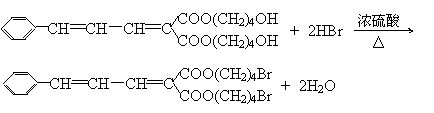 (4)
(4)
(2分)
六、(本题包括2小题,共15分)
27.(本小题共5分) (不需写计算过程)
(l)ω(Z)=0.4 (1分),40%(2分)
(2)0.5<![]() <5
即
0.5<
<5
即
0.5<![]() <5 (2分)
<5 (2分)
28.(10分)
n(H2Cr2O7)=![]()
(列式2分结果1分共3分)
m(Cr)=![]() =78mg
(2分)
=78mg
(2分)
(2) Fe(OH) 3 、Ca SO4 (各1分共2分)
1×104升废水中含有铬的物质的量为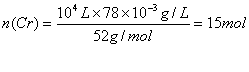 (1分)
(1分)
需绿矾的质量m(FeSO4·7H2O)=278 g∙mol-1×15mol×6×![]()
=12510g=12.51Kg (2分)
