湖北宜昌2005-2006学年度第一学期高三年级调研考试化学试卷
(附答案)
2006.1
YCY
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。考试时间90分钟,满分100分。
可能用到的相对原子质量: H 1 He 4 C 12 O 16 Na 23 S 32
第一卷(选择题共45分)
选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是 ( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
2.下列对物质用途的描述中,错误的是 ( )
A.浓硫酸可用于干燥NH3、H2、O2等气体
B.二氧化硫可用来漂白纸浆、毛、丝等
C.氟化钠可用于预防龋齿
D.红磷用于制备安全火柴
3.下列金属冶炼的反应原理,错误的是 ( )
A.2NaCl(熔融) ![]() 2Na+Cl2
2Na+Cl2
B.MgO+H2 ![]() Mg+2H2O
Mg+2H2O
C.Fe3O4+4CO ![]() 3Fe+4CO2
3Fe+4CO2
D.2HgO ![]() 2Hg+O2
2Hg+O2
4.炭跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是 ( )
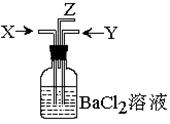
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.在Z导管口有黄绿色气体出现
5.将足量稀盐酸加入下列固体混合物中,只能发生一个反应的是 ( )
A.Mg、AlCl3、NaAlO2 B.KNO3、NaCl、CH3COONa
C.NaClO、Na2SO3、BaCl2 D.Ba(NO3)2、FeSO4、NH4HCO3
6.NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.10 g甲烷所含有的电子数目为10NA
B.常温常压下,4 g氦气所含有的中子数目为4NA
C.标准状况下,22.4 L单质溴所含有的原子数目为2NA
D.电解食盐水若产生2 g氢气,则转移的电子数目为2NA
7.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、![]() 、
、![]() B.Na+、
B.Na+、![]() 、Cl-、ClO-
、Cl-、ClO-
C.H+、Mg2+、![]() 、
、![]() D.Ag+、K+、
D.Ag+、K+、![]() 、Na+
、Na+
8.下列反应的离子方程式正确的是 ( )
A.向小苏打溶液中加入醋酸溶液:![]() +H+ =CO2↑+H2O
+H+ =CO2↑+H2O
B.向Ca(ClO)2 溶液中通入过量二氧化硫:SO2+H2O+Ca2++ClO-= CaSO3↓+HClO
C.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH- =![]() +2H2O
+2H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2++Cl2=Fe3++2Cl-
9.下列实验操作或事故处理中,正确的做法是 ( )
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.用碱石灰吸收氨气中的水蒸气
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.用酒精萃取碘水中的碘
10.100 mL 0.1 mol·L-1醋酸与50 mL 0.2 mol·L-1氢氧化钠溶液混合,在所得溶液中( )
A.c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
11.pH=a的某电解质稀溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是 ( )
A.NaOH YCY B.H2SO4 C.AgNO3 D.Na2SO4
12.有下列四组物质,如果把某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是 ( )
A.氯化钠溶液、硝酸银溶液 B.硫酸亚铁溶液、氢氧化钠溶液
C.氯化铝溶液、浓氨水 D.偏铝酸钠溶液、稀硫酸
13.下列叙述正确的是 ( )
A.铜锌原电池中铜为负极
B.0.1 mol N2与0.1 mol H2在一定条件下反应达到平衡时,生成0.2 mol氨
C.18 g H2O中含1 mol氧原子
D.1 mol·L-1 AlCl3溶液中,铝离子物质的量浓度为1 mol·L-1
14.下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
| X | |||
| W | Y | R | |
| Z | |||
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物沸点比X的氢化物的沸点高
15.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
A.2 mol C
B.2 mol A 3mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A 3 mol B和3 mol C
第二卷(非选择题 共55分)
本试卷包括5小题
16.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能 / kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:YCY
(1)比较下列两组物质的熔点高低(填“>”或“<”![]()
SiC______Si;SiCl4_________Si
(2)已知工业上高纯硅(1molSi中含2mol硅-硅键)通常用SiCl4(g)与H2反应制备,写出该反应的热化学方程式__ ____
17.(11分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)w的元素符号是 ,它的原子结构示意图为 。
(3)Z2Y2与X2Y反应的化学方程式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
18.(14分)A、B、C、D、E、F、G、X、Y和M等物质有如图转化关系,其中M为黑色粉末,X、Y为常见的气体单质,D、G为常见金属单质。上述各步转化中只写出其中一种生成物,其他生成物没有写出(也可能反应 只有一种生成物)。
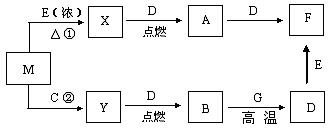
(1)写出有关物质化学式:M ,X ,C 。
(2)指出M在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)写出A→F离子方程式 。
(4)写出B→D化学方程式 。
19.(14分)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,实验步骤如下:
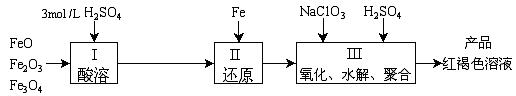
(1)用98%的硫酸配制3mol /L的硫酸,所需的玻璃仪器除量筒、烧杯、玻璃棒外,还有 。
(a)容量瓶 (b)胶头滴管 (c)烧瓶
(2)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4 =3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4 =3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
聚合硫酸铁溶液中![]() 与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(3)测定时所需的试剂 。
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
(4)需要测定 和 的质量(填写化合物的化学式)。
(5)选出测定过程中所需的基本操作(按操作先后顺序列出) 。
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶
(d)冷却、称量 (e)烘干或灼烧
20.(8分)CO、C2H4均为常见的可燃性气体。
(1)等体积的CO和C2H4在相同条件下分别完全燃烧,转移的电子数之比是
(2)120℃、101 kPa下,a mL由CO、C2H4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
① 若混合气体与O2恰好完全反应,则混合气体中C2H4的体积为 mL(用含a、b的式子表示)。
② 若燃烧后气体体积缩小了![]() mL,则混合气体中CO的体积为
mL,a与b
mL,则混合气体中CO的体积为
mL,a与b
关系的数学表示式是 。
参考答案
第一卷(选择题 共45分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | A | B | C | B | D | B | C |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| B | C | A | D | C | C | A |
第二卷(非选择题 共55分)
16.(8分)(1)>(2分); <(2分)
(2)SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),△H=+236kJ /
mol(4分)
Si(s)+4HCl(g),△H=+236kJ /
mol(4分)
17.(11分)(1)Na2O(2分)
(2)Cl(2分),原子结构示意图略(2分)
(3)2Na2O2+2H2O=4NaOH+O2↑(2分)
(4)Cu+H2O2+2H+=Cu2++2H2O(3分)
18.(14分)(1)MnO2(2分); C12(2分); H2O2(或KClO3)(2分);
(2)氧化(2分); 催化(2分)
(3)2Fe 3+ + Fe = 3Fe 2+(2分)
(4)3Fe3O4+8Al![]() 4Al2O3+9Fe(2分)
4Al2O3+9Fe(2分)
19.(14分)
(1)a、b(2分)(见错无分,只选对一个给1分)
(2)利:原料成本较低 (2分) 弊:产生气体对大气有污染(2分)
(3)a、c(2分)
(4)Fe2O3(2分)、BaSO4(2分)
(5)b、e、d(2分)(全对给分)
20.(8分)(1)1∶6(2分)
(2)① ![]() (2分) ②
(2分) ②![]() (2分), b≥
(2分), b≥![]() (2分)
(2分)