高07级实验班针对训练四
1、有时候,将氧化还原方程式拆开写成两个“半反应”。下面是一个“半反应”式:
( )NO3- + ( )H+ + ( )e- =( )NO + ( )H2O ,该式的配平系数是( )
A.1,3,4,2,1 B.2,4,3,2,1
C.1,6,5,1,3 D.1,4,3,1,2
2、实验室用KClO3和浓盐酸反应制取氯气,化学方程式为KClO3+6HCl=KCl+3Cl2↑+3H2O若生成71g氯气,则被氧化的氯化氢为( )
A.73g
B.![]() ×36.5g
C.3×36.5g D.
×36.5g
C.3×36.5g D.![]() ×36.5g
×36.5g
3、下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质,D属于可溶于水的强电解质,一个D分子中含有18个电子。
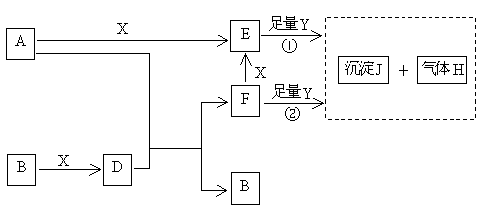
(1)化学式:B为_________,F为_________;
(2)写出D的电子式_________,液态D能否导电_________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)_________;
a. 直接与氧气发生化学腐蚀 b. 通过原电池反应发生腐蚀 c. 因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:____________________________________________________;
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为:
__________________________________,____________________
4、已知:碱金属或碱土金属(ⅡA)与H2在隔绝空气加热时可以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备纯净CaH2的实验,装置如图所示(分别以序号I、II表示),铁架台等夹持固定仪器已略去(H2的稳定性强于HCl)。
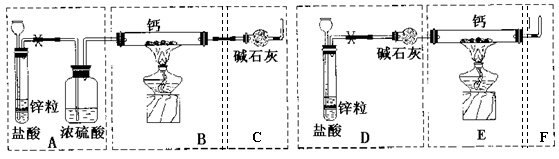 Ⅰ
Ⅱ
Ⅰ
Ⅱ
请回答下列问题
(1)锌与盐酸反应的离子方程式为: ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置I的不足之处是: ,
装置II的不足之处是: ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再 ,才能点燃酒精灯加热。
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 ,该反应中的氧化剂是___ __。
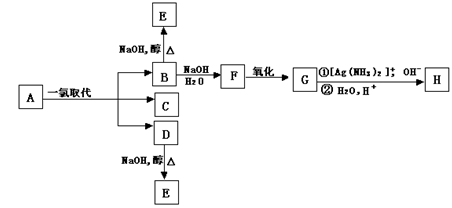 5、烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是(CH3)2C(CH2CH3)CH2Cl 。 B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
5、烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是(CH3)2C(CH2CH3)CH2Cl 。 B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
请回答:
(1)A的结构简式是 。
(2)H的结构简式是 。
(3)B转变为F的反应属于 反应(填反应类型名称)。
(4)B转变为E的反应属于 反应(填反应类型名称)。
(5)1.16gH与足量NaHCO3作用,标准状况下可得CO2的体积是 mL。
6、有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为_______________________。
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m3的取值范围是___________________。
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
求:(ⅰ)盐酸的物质的量浓度为多少?
(ⅱ)合金中镁的质量分数为多少?
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
参考答案:
1、D.2、B.3、(1)H2 FeCl2(2)![]() 否(3)b
否(3)b ![]()
(4)![]()
![]()
4、(1)Zn+2H+=Zn2++H2↑ (2)缺少除去HCl的装置;缺少防止空气中水蒸汽进入的装置
(3) D B (E) C (4)通氢气;验纯 (5) CaH2+2H2O=Ca(OH)2+H2↑;H2O;
5、(1)(CH3)3CCH2CH3 (2)(CH3)3CCH2COOH (3)取代(或水解)(4)消去(5)224
6、(1)47.06% (2) 0.80V<m<1.07V或27V/33.6<m<24V/22.4或9V/11.2<m<3V/2.8 (3)78