化学基础补习题11 姓名
1.
常温下,向20升真空容器中通入amol尔硫化氢和bmol尔氯气(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最大密度是------------------------------------------------------(B)
(A)19.45g/L
(B)18.25g/L
(C)17.85g/L
(D)35.5g/L
〖提示〗:氯气在与硫化氢反应时,不管氯气过量与否,其中的氯元素始终存在于气体中,当氯化氢取最大值(b=5)时才符合题意,同时,考虑到与氯元素结合的氢越多,气体的质量也越大,密度值也越大,所以硫化氢在允许的前提下也是越大越好(a=5),可求得此时气体的密度为18.25g/L,答案为B。如果反过来考虑:硫化氢中的氢元素也始终存在于气体中,硫化氢理当取最大值,氯元素的量也应该最大,同样也可推得答案为(B)[经计算,当a:b的值为1:5.45(不是正整数,不符合题意)时,为A;
当a:b的值为5:5时,为B; 当a:b的值为1:5时,为C; 当a:b的值为0:n时(此时不是混和气体,全是氯气,已不符合题意),气体的密度为17.75g/L,所以D是无论如何也达不到的.
2.
用足量的氢气和氧气分别跟mg硫反应,并将生成物混和,可生成的硫为 (B)
(A)2mg
(B)1.5mg
(C)mg
(D)0.5mg
3.
为除去SO2中混有的少量SO3,并使所得物质的平均相对分子质量尽可能地增大,应选用的物质是-(D)
(A)亚硫酸钠溶液 (B)亚硫酸氢钠溶液 (C)碱石灰 (D)浓硫酸
〖提示〗:浓硫酸与SO3生成H2SO4·nSO3
4.
工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4 = H2SeO3+Cl2+H2O),再通入SO2于亚硒酸的溶液中,单质硒柝出,据此下列叙述正确的是---------------------------------------------------------------------(AB)
(A) H2SeO4的氧化性强于Cl2
(B)亚硒酸的氧化性强于亚硫酸
(C)SeO2还原性强于SO2 (D)柝出1mol尔硒,1mol尔SO2
5.
298K时,向V升真空容器中通入nmolSO2和mmolH2S。若5n=m,且反应后氧化产物与还原产物的质量和为48g,则n与m之和为--------------(C)
(A)1 (B)2 (C)3 (D)4
〖提示〗:硫化氢过量1.5mol
6.
t℃时,在100g水中加入w1克无水硫酸锌或加入w2克皓矾晶体,都可使溶液达到饱和状态,则w1与w2的关系符合于------------------------------------[B]
(A)w1=![]() w2
(B)w1=
w2
(B)w1=![]() (C)w1=
(C)w1=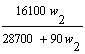 (D)w1=
(D)w1=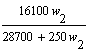
〖提示〗: 两者均在100g水中形成饱和溶液,则溶液中溶剂与溶质的比例相等,也就是:100:W1=(100+W2×![]() ):W2×
):W2×![]()
7.
已知白磷与氧气可发生如下反应:P4+3O2 == P4O6 P4+5O2
== P4O10,现在某密闭容器中加入62g白磷和50.4升氧气(标准状况),使之恰好完全反应,则所得到的P4O10与P4O6的物质的量之比为---(C)
(A)1:3 (B)3:2 (C)3:1 (D)1:1
〖提示〗:由题给的物质的量,采用直接配平法:2P4+9O2=xP4O10+yP4O6,再根据质量守恒求得x=1.5,y=0.5。
8.
磷和氧气的反应,在两个容器中分别控制不同条件按如下两种形式进行反应: P4+3O2 == 2P2O3 P4+5O2
== 2P2O5。若在两容器中分别放入1mol磷和1mol氧气,经充分反应,分别得到P2O3 与P2O5的物质的量之比为------(C)
(A)1:1 (B)2:1 (C)5:4 (D)5:3
〖提示〗: 这里没有指明是白磷还是红磷,不过这不要紧,只要前后一致就行,这道题的关键问题是当这两种物质反应时,生成P2O3时氧气过量,所有的磷全部反应,而生成P2O5时磷过量,磷不能完全参与反应。
9.
把11.9gH2S和11.2升(标准状况)O2,在一密闭容器中混和,在一定条件下充分反应后,测知反应物无剩余,再回复到原来状况,则容器中氧化产物的总质量是--------------------------------------------(C)
(A)10.8g (B)11.2g (C)21.6g (D)22.4g
〖提示〗: H2S和O2的反应可能有两种情况(反应式略),氧化产物可能是硫或二氧化硫或这两者的混和物。由氢元素的质量守恒有:水的质量=![]() g,则氧化产物的质量=11.9+
g,则氧化产物的质量=11.9+![]() -6.3=21.6g。
-6.3=21.6g。
10. 常温下,H2S与O2两气体混和,充分燃烧后H2S无剩余,恢复到原来的状态时,所得SO2的气体体积是原H2S气体体积的三分之一。则原H2S与O2的体积比是-----------------------------------------(B)
(A)1:3 (B)6:5 C:5:6 (D)4:3
〖提示〗:依据氧原子和硫原子在反应前后的原子个数不变这一规律。设生成的SO2的体积为a,其化学方程式为:
3aH2S+![]() O2 == aSO2+2aS+3aH2O
O2 == aSO2+2aS+3aH2O
则![]()
11. 将x mol Na2SO3和ymol Na2S溶于水中,用硫酸酸化后,①若生成S和SO2,②若生成S和H2S,③若只生成S,则x:y的值依次为------------〖B〗
(A)>![]() ,=
,=![]() ,<
,<![]() (B)>
(B)>![]() ,<
,<![]() ,=
,=![]() (C)=
(C)=![]() ,>
,>![]() ,<
,<![]() (D)<
(D)<![]() ,>
,>![]() ,=
,=![]()
12. 用浓硫酸吸收![]() 可以得到
可以得到![]() ,若用1000g98%的
,若用1000g98%的![]() 充分吸收
充分吸收![]() 后,再进行稀释,可得到98%的硫酸的质量为---------------------[C]
后,再进行稀释,可得到98%的硫酸的质量为---------------------[C]
(A)1980g (B)2000g (C)2222g (D)2420g
〖提示〗 :要注意1000g98%的硫酸中还有20g水!
1000g98%H2SO4溶液![]() ,最终可以得到
,最终可以得到![]() H2SO4
H2SO4
13. 有一亚硫酸钠,可能已经变质。现将亚硫酸钠试样烘干后,称取ag,用蒸馏水溶解,加足量硝酸钡溶液,滤出生成的沉淀,洗净、干燥,得沉淀bg,试写出下列三种情况b与a的关系式::
(1)当亚硫酸钠没有变质时【答:![]() 】
】
(2)当亚硫酸钠部分变质时【答:![]() 】
】
(3)当亚硫酸钠完全变质时【答:![]() 】
】
14. A、B、C是三种中学化学中常见的化合物,它们各由两种元素组成,甲、乙是两种单质。这些化合物与单质之间存在以下关系:
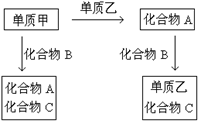
据此推断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是【答:A与B】(填写字母)。
(2)单质乙必定是【答:非金属】元素(填“金属”或“非金属”),其理由是【答:在化合物A中,乙元素呈正价,而在化合物B中,乙元素呈负价,金属元素不可能出现负价】。
(3)单质乙可能是【答:硫】,则化合物B的分子式是【答:![]() 】
】
15. 足量的浓硫酸中加入ag铜,完全反应放出b升气体;足量的稀盐酸中加入mgFeS,完全反应放出n升气体(气体体积均在标况下测定)。已知两者生成的气体正好完全反应,则a:m:b:n=【答】:4:11:7:14
16. 某无色溶液可能含有下列钠盐中的几种:(A)氯化钠 (B)硫化钠 (C)亚硫酸钠 (D)硫代硫酸钠 (E)硫酸钠 (F)碳酸钠。向些溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色,。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色,这说明气体中不含【答:二氧化硫】。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填相应的字母,不要求一定填满)。
| 第一种情况 | 第二种情况 | 第三种情况 | 第四种情况 |
| 【答:BCF】 | 【答:BDF】 |
17. amolH2S和一定量的O2在一容积可变的密闭容器中混合点燃反应完毕后已知![]() 无剩余。恢复到反应的状态(1.01×105Pa、120℃),气体的体积是反应前气体体积的b%。
无剩余。恢复到反应的状态(1.01×105Pa、120℃),气体的体积是反应前气体体积的b%。
(1)若b=70时,写出点燃后可能发生的化学方程式:
〖提示〗:有两种情况:一是![]() 过量;二是产物中既有单质硫,也有二氧化硫:a
过量;二是产物中既有单质硫,也有二氧化硫:a![]() +x
+x![]() ®?S+
®?S+![]() +a
+a![]() ,由于
,由于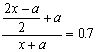 ,解得x=2,a=3,从而可以写出相应的化学方程式。
,解得x=2,a=3,从而可以写出相应的化学方程式。
(2)若70£b£80,设参加反应![]() 的物质的量为mmol,则m的取值范围是:
的物质的量为mmol,则m的取值范围是:
〖提示〗:当![]() 过量时,
过量时,![]() £m£
£m£![]() ;当产物中既有单质硫,又有二氧化硫时,
;当产物中既有单质硫,又有二氧化硫时,![]() £m£
£m£![]()
18. 以下每小题由两个叙述句组成,判断两个叙述句是否正确。若两句均正确,则判断第二句是否为第一句的合理解释。根据表中列出的A~E项,选出正确答案,将字母填入每小题后的括号内。
| 选项 | A | B | C | D | E |
| 第一叙述句 | 正确 | 正确 | 正确 | 错误 | 错误 |
| 第二叙述句 | 正确,且是第一句的合理解释 | 正确,不是第一句的合理解释 | 错误 | 正确 | 错误 |
(1)浓硫酸与锌反应生成氢气,浓硫酸具有酸的通性【答:D】
(2)浓硫酸中[![]() ]一定比稀硫酸大,浓硫酸与铁反应生成的氢气比稀硫酸多。【答:E】
]一定比稀硫酸大,浓硫酸与铁反应生成的氢气比稀硫酸多。【答:E】
(3)浓硫酸和空气接触后质量增加。浓硫酸具有脱水性。【答:B】
(4)浓硫酸可以干燥氯化氢。浓硫酸具有吸水性。【答:A】
(5)浓硫酸在常温下与铜激烈反应生成硫酸铜、二氧化硫和水。浓硫酸具有强氧化性。【答:D】
(6)浓硫酸可以用铁质容器贮存。浓硫酸不与铁反应。【答:C】
19. 有两种无机盐A和B,其相对分子质量都120,为了确定A和B,将它们分别溶于水制成溶液,进行下列实验:①将两种溶液混和立即产生一种易溶于水、易液化的气体;②在两种溶液中分别加入氯化钡溶液,A溶液无沉淀产生,B溶液里有白色沉淀柝出;③在两种溶液里分别加入过量的氢氧化钡溶液均有白色沉淀产生,请确定A、B两种盐的名称。
【解:A-亚硫酸氢钾 B-硫酸氢钠】
20. 实验测得化合物A中各元素质量百分组成为钾a%,硫b%,其余是氧;B中含钾d%,硒e%,其余是氧,若A、B的化学式相似,且已知硫相对原子质量为32,则硒的相对原子质量是多少?【答:Se的相对原子质量=![]() 】
】
〖提示〗:由于化学式相似,故有如下的表示式:
![]() ,可以解得:Se的相对原子质量=
,可以解得:Se的相对原子质量=![]()
21. 硫元素可形成多硫化物,如K2Sx(x=2~6)。为测定x值,使K2Sx在碱性条件下与![]() 反应。反应中
反应。反应中![]() 被氧化成SO
被氧化成SO![]() ,
,![]() 则被还原成为
则被还原成为![]() 。
。
①如果当K2Sx恰被全部氧化时,消耗![]() 与K2Sx的物质的量之比为7:3,则x=【答:2】。
与K2Sx的物质的量之比为7:3,则x=【答:2】。
〖提示〗:7![]() ®7
®7![]() 化合价降低量为42,则3 K2Sx®3xSO
化合价降低量为42,则3 K2Sx®3xSO![]() 化合价上升量
化合价上升量![]() ,解得x=2。
,解得x=2。
②以上反应的离子方程式是:
【答:3![]() +7
+7![]() +6
+6![]() =6SO
=6SO![]() +7
+7![]() +3
+3![]() 】
】