中学化学《氧化还原》迎考习题
选 择 题
1.下列叙述正确的是-----------------------------------------------------------------(A)
A.卤素离子(X-)只有还原性而无氧化性
B.某元素由化合态变成游离态,该元素一定被氧化
C.失电子难的原子获得电子的能力一定强
D.卤素最高价氧化物的分子式都为X2O7
〖提示〗:氟元素不存在氧化物(但氧可以存在氟化物,如OF2)
2.单质X和Y反应生成的化合物X2+Y2-,现有下列叙述:ŒX被氧化X是氧化剂ŽX具有氧化性XY既是氧化产物又是还原产物XY中的Y元素具有还原性‘XY中的X元素具有氧化性’Y的氧化性比X2+强“Y2-的还原性比X的还原性强,上述说法中,都正确的组合是-------------------------------------------(A)
A.Œ‘ B.Ž C.‘“ D.‘’“
〖提示〗:’也正确
3.一定条件下KClO3与I2发生反应:2KClO3+I2=2KIO3+Cl2,由此推断下列相应的结论,不正确的是----------------------------------------------------------------(C)
A.该反应属置换反应 B.还原性:I2>Cl2
C.非金属性:I>Cl D.氧化性:KClO3>I2
4.下列四种溶液中,分别加入MnO2固体少量,能产生气体的是-------------(A)
A.3%H2O2溶液 B.1摩/升NaOH溶液
C.1摩/升盐酸 D.1摩/升KClO3溶液
5.下列物质在空气中久置变质,在变质过程中既有氧化还原-反应发生,又有非氧化还原反应发生的是-------------------------------------------------------------(D)
A.溴水 B.绿矾 C.电石 D.漂白粉
6.在3BrF3+5H2O==HBrO3+Br2+9HF+O2的反应中,如果有9克水被消耗时,被还原BrF3的的量为-----------------------------------------------------------------------(B)
A.0.1摩 B.0.2摩 C.0.3摩 D.0.9摩
7.判断An+比Bm+的性强,下列根据正确的是------------------------------------(A)
A.mAn++nB == mA+nBm+
B.mAn++C
== mA +Cmn+,nBm++C == nB+Cmn+
C.A、B为同周期元素,其最高化合价分别是+n、+m,且m>n
D.A、B为同主族元素,n=m=最高正价,A比B的原子序数大
8.X和Y两元素的原子,当它们分别获得一个电子后都能形成稀有气体的电子层结构,过程中X放出的能量大于Y,那么下列推断中不正确的是-----------(A)
A.X-的还原性强于Y- B.Y的氧化性弱于X
C.X的原子序数小于Y D.X-的还原性弱于Y-
9.KClO3和MnO2混和物20.95克,加热到质量不再减少时为止,剩余固体16.15克,向剩余物中加入过量浓硫酸可放出气体,该气体与过量KI反应,生成的I2用Na2S2O3溶液吸收:
I2+2Na2S2O3==2NaI+Na2S4O6,问需1摩/升的Na2S2O3溶液几毫升,才能把生成的I2全部吸收------------------------------------------------------------------------------(C)
A.50毫升 B.33.3毫升 C.100毫升 D.66.7毫升
〖提示〗:加热反应后生成的MnCl2在过量的浓硫酸作用下,其中的氯元素全部被氧化成氯气MnCl2![]() Cl2,如果不注意到这一点,很可能受到教材中的反应:MnO2+4HCl
== MnCl2+Cl2+2H2O的影响而错选A
Cl2,如果不注意到这一点,很可能受到教材中的反应:MnO2+4HCl
== MnCl2+Cl2+2H2O的影响而错选A
10.不同的卤素原子之间能形成卤素互化物,其通式可表示为XX¢n(n=1、3、5、7)。这种卤化物大多数不稳定,易发生水解反应。如果BrFn跟水反应时物质的量之比为3:5,生成溴酸、氢氟酸、溴单质和氧气,则下列叙述正确的是------------------------------------(AC)
A.此卤素互化物的分子式为BrF3
B. 此卤素互化物的分子式为BrF5
C.每摩BrFn跟水完全反应可生成等物质量的Br2和O2
D. BrFn的许多性质类似于卤素单质,有强的还原性
〖提示〗:先写出如下的反应式:
3BrFn+5H2O
= (10-3n)HBrO3+3nHF+![]() Br2+
Br2+![]() O2
O2
由于10-3n>0 ![]() >0
>0 ![]() >0,可得唯一解:n=3
>0,可得唯一解:n=3
11.元素周期律与原子结构理论出现的年号-------------------------------------(B)
A.前者大 B.后者大 C.相等 D.不能确定
99.第二周期非金属元素形成常温下的气态氢化物和气态氧化物的种类--(A)
A.前者大 B.后者大 C.相等 D.不能确定
12.下列操作不会引起化学反应的是------------------------------------------------(B)
A.硝酸亚铁溶液中加入稀硫酸 B.将氧气和氢气以1:2体积比混和
C.向漂白粉中滴加稀硫酸 D.将次氯酸钠溶液与硫化钠溶液混和
13.R2O8n-离子在一定条件下可以把Mn2+氧化成MnO4-,项反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是---------------------------------------------------------------------------------------------(B)
A.1 B.2 C.3 D.4
14.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是------( C )
A.NO2 B.NO C.N2O D.N2
〖提示〗:根据电子得失守恒可知:
2R![]() 2R(NO3)n(R表示金属元素)
2R(NO3)n(R表示金属元素)
HNO3![]()
![]() (n表示R的化合价)
(n表示R的化合价)
即2ne=(5-x)e(x表示还原产物N化合价)
当n=1时,x =3,无答案(N2O3) 当n=2,=+1,答案为C
15.为实现我国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知溶液中IO3-可以与I-发生如下的反应:
IO3-+5
I-+6H+ == 3I2+3H2O
据此反应,可用试剂和一些生活中常见的物质进行试验,证明在食盐在存在着IO3-。可供选用的物质是:①自来水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒。进行上叙实验时必须使用的物质是---------( B )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
16.下列原子或离子中,氧化性最强的是------------------------------------〖B〗
还原性最强的是------------------------------------------------------------------------〖A〗
A.Mg B.Cu2+ C.Fe D.Na+
17.
14克铜、银合金与足量的某浓度的硝酸反应,将放出气体与1.12升(标况)氧气混合,通入水中恰好全部吸收,则合金中铜的质量是----------------[C]
A、9.6克 B、6.4克 C、3.2克 D、1.6克
〖提示〗:硝酸浓度不必考虑,因为硝酸得到的电子数将在氮的氧化物与氧气反应中全部由氧气补偿。
18.
将两种硫酸盐按一定质量比混和后制得化合物W,已知W溶于水可电离出K+、Cr3+和SO![]() 。现将2.83克W中的Cr3+全部氧化成为Cr2O
。现将2.83克W中的Cr3+全部氧化成为Cr2O![]() 后,这些Cr2O
后,这些Cr2O![]() 再和过量的KI溶液反应得到3.8克I2(Cr2O
再和过量的KI溶液反应得到3.8克I2(Cr2O![]() +6I-+14H+=2Cr3++3I2+7H2O);另取2.83克W投入到过量的BaCl2溶液中,得到4.66克白色沉淀,由此判断W的化学式为----------------------------------------------[D]
+6I-+14H+=2Cr3++3I2+7H2O);另取2.83克W投入到过量的BaCl2溶液中,得到4.66克白色沉淀,由此判断W的化学式为----------------------------------------------[D]
A、K2Cr(SO4)3 B、K3Cr2(SO4)3
C、KCr3(SO4)3 D、KCr(SO4)2
19.
检验NO![]() 的方法是:在试液中加入饱和
的方法是:在试液中加入饱和![]() 溶液摇匀,将试管倾斜成45°左右,沿管壁缓慢加入硫酸,静置片刻,在两液体的界面上有棕色环产生,这种棕色环的主要成份是---------------------------------------------------------------[B]
溶液摇匀,将试管倾斜成45°左右,沿管壁缓慢加入硫酸,静置片刻,在两液体的界面上有棕色环产生,这种棕色环的主要成份是---------------------------------------------------------------[B]
A、![]() B、Fe(NO)SO4
B、Fe(NO)SO4
C、Fe(NO2)SO4 D、Fe(OH)SO4
20.
已知IBr的性质与卤素相似,![]() 的结构为
的结构为 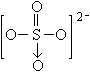 ,
,![]() 的结构为
的结构为 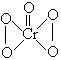 ,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是-------------------------------------------------------------------------------------------------[D]
,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是-------------------------------------------------------------------------------------------------[D]
①IBr+![]() =HIO+HBr ②
=HIO+HBr ②![]() +2
+2![]() =S¯+
=S¯+![]() +
+![]()
③![]() +4
+4![]() +2
+2![]() =2
=2![]() +5
+5![]() ④ 2HOF=2HF+
④ 2HOF=2HF+![]()
A、①②③④ B、只有②③④ C、只有④ D、只有②
21.
保险粉是连二亚硫酸钠(![]() )的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入
)的工业俗名,年产量达30万吨,是最大量生产的无机盐之一。生产保险粉主要用甲酸法,其最主要的步骤上是把甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入![]() 气体,所发生的化学反应是:HCOONa+2
气体,所发生的化学反应是:HCOONa+2![]() +NaOH=
+NaOH=![]() +
+![]() +
+![]() ,以下有关叙述中错误的是--------------------------------------------------------------------------------[B]
,以下有关叙述中错误的是--------------------------------------------------------------------------------[B]
A、在此反应中,HCOONa是还原剂,![]() 是氧化剂
是氧化剂
B、保险粉的还原性比HCOONa的还原性强
C、NaOH未被氧化也未被还原
D、甲醇虽未参加反应,但有助于保险粉的结晶、分离
填 空 题
1.一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e=Cu2+;还原反应:Fe3++e=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:
【答】:氧化反应:H2O+NO2-e=NO3-+2H+
还原反应:2H++NO2+2e=NO+H2O
2.为研究第VIII族元素的性质递变规律,现取两只试管,在试管①中盛Fe(OH)3,在试管②中盛Co(OH)3,向两支试管中各加入浓盐酸,并在试管口放湿润的KI淀粉试纸,结果发现试管①中沉淀溶解,试管口试纸不变色;试管②中沉淀溶解,且试管口试纸变蓝色,根据上述实验,可推知:Fe3+的氧化性比Co3+的氧化性【答】:弱(强或弱);有关反应的离子方程式为:
【答】:Fe(OH)3+3H+
== Fe3++3H2O
2Co(OH)3+6H++2Cl-
== 2Co2++Cl2+6H2O
Cl2+2I- == I2+2Cl- 。
3.在KI和H2SO4 溶液中加入H2O2 ,放出大量不溶于水的无色气体(气泡从溶液内部放出),同时溶液呈紫红色,且可使淀粉变蓝,写出化学方程式.
【分析】:这是一道颇为简单但却很容易出错的化学题,错误的原因大多是把实验现象看成只是一个反应的现象,其实,实验现象往往是若干个反应共同体现出来的,该题就是如此.有的同学认为产物中有I2 和O2 ,这没有错,但如果认为这两种物质均是由一个反应得到的话,这就错了,因为在这个反应中,这两种物质均是氧化产物,哪么还原剂是什么呢?如果还原剂是H2SO4 ,则应该有SO2生成,与题意不符,而且稀H2SO4 也没有这么强的氧化性.
H2O2 +2KI+H2SO4 =I2 +K2SO4 +2H2O
2H2O2 =2H2O+O2 ↑
4.Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu和Cu2+,现只有浓硫酸,浓硝酸,稀硫酸,稀硝酸,氯化铁稀溶液及PH试纸,简述如何用最简便的方法来检验氧化铜经氢气还原所得的红色物质中是否含有碱性氧化物Cu2O?
【分析】:用稀硫酸溶解红色物质,再根据溶液是否呈蓝色得出结论.
不能用题中给出浓酸,因为它们有强氧化性,不管有无Cu2O,均能生成蓝色溶液,也不能用氯化铁溶液,因为它能与铜反应生成正二价的铜离子而也使溶液呈蓝色,干扰检验.
5.今有A、B两个试管,A试管装有用硫酸酸化的高锰酸钾溶液,B试管装有亚硫酸溶液.实验发现,将少量的A液滴入B液中和将少量的B液滴入A液中现象不同.
试解释之.
【解释】:① 将少量的A液滴入B液中时,高锰酸钾不足,而还原剂(亚硫酸)过量,反应的结果是高锰酸钾溶液的颜色完全褪去:
KMnO4 +5H2SO3 =2MnSO4 +K2SO4 +2H2SO4 +3H2O
② 将少量的B液滴入A液中时,高锰酸钾过量,+7价的Mn元素不能完全被还原成+2价,最后溶液中将出现不溶物(MnO2)
a: 2KMnO4 +5H2SO3 =2MnSO4 +K2SO4 +2H2SO4 +3H2O
b: 2KMnO4 +3MnSO4 +2H2O=5MnO2 +2H2SO4 +K2SO4
将a、b两式合并,可得:
2KMnO4 +3H2SO3 =2MnO2↓+2H2SO4 +K2SO4 +H2O
6.不溶于水的氧化亚铜,可溶于含有硫酸的硫酸铁溶液,发生的反应为:
Cu2O+Fe2(SO4)3+H2SO4
= CuSO4+FeSO4+H2O
反应中生成的硫酸亚铁可用高锰酸钾的硫酸溶液滴定,发生的反应为:
FeSO4+KMnO4+H2SO4
= K2SO4+MnSO4+Fe2(SO4)3+H2O
用以上方法可测得氧化亚铜的量。
(1)配平以上两个反应方程式:
【答: Cu2O+Fe2(SO4)3+H2SO4
= 2CuSO4+2FeSO4+H2O
10FeSO4+2KMnO4+8H2SO4
= K2SO4+2MnSO4+5Fe2(SO4)3+8H2O】
(2)400毫克氧化亚铜样品中生成Fe2+可被1毫升1摩/升的高锰酸钾溶液刚好滴定,则样品中Cu2O的百分含量是多少(设样品中含有的是惰性杂质)【答:90%】
7.已知氧化性Cl2>Br2>Fe3+。往500毫升2.0摩/升的FeBr2溶液中通入a摩氯气,试确定a不同取值范围时的氧化产物及其对应的物质的量,填入下表:
| a值的范围 | 氧化产物及其物质的量 |
| 0<a£ | 【答:FeBr3= |
|
| 【答:FeBr3= |
| a³ | 【答:FeCl3=1摩, Br2=1摩】 |
〖提示〗:当![]() <a£
<a£![]() 时,可采用直接配平法:
时,可采用直接配平法:
FeBr2+aCl2
= ![]() FeBr3+
FeBr3+![]() Br2+
Br2+![]() FeCl3
FeCl3
8.配平下列氧化-还原反应
(1)【2】KMnO4+【5】SO2+【2】H2O ==
【2】MnSO4+【1】K2SO4+【2】H2SO4
(2)【6】KI+【2】K2CrO4+【6】HCl == 【2】CrCl3+【10】KCl+【3】I2+【8】H2O
(3)【1】K2Cr2O7+【6】Fe3O4+【31】H2SO4
== 【1】Cr2(SO4)3+【9】Fe2(SO4)3+【1】K2SO4+【31】H2O
(4)【1】As2S3+【10】HNO3
== 【2】H3AsO4+【3】S+【10】NO2+【2】H2O
9.
有一种稀有气体化合物六铂氟酸氙XePtF6,研究报告指出:“关于XePtF6的电价有Xe2+[PtF6]2-、Xe+[PtF6]-两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答:
(1)XePtF6中各元素的化合价分别是 、 、 。
(2)XePtF6是 (离子、共价)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式
。而且O2与PtF6可发生类似反应,其反应式是
,上述两反应属( )
A、均为氧化还原反应 B、均为非氧化还原反应
C、前者是氧化还原反应,后者是非氧化还原反应
【提示】:(1)+1、+5、-1 (2)离子 (3)Xe+PtF6=XePtF6
O2+PtF6=O2PtF6 A
10.
在水溶液中N2H![]() 将Fe3+还原为Fe2+:N2H
将Fe3+还原为Fe2+:N2H![]() +4Fe3+®4Fe2++Y+…,则Y可能是 。该反应的离子方程式为
。
+4Fe3+®4Fe2++Y+…,则Y可能是 。该反应的离子方程式为
。
【提示】:N2、N2H![]() +4Fe3+®4Fe2++N2+5H+
+4Fe3+®4Fe2++N2+5H+
11.
用氯酸钾加热分解法制得的氧气常含有微量的氯气和臭氧。为测定氯气和臭氧的含量,将氯酸钾受热分解后所得气体V1升通过足量的KI溶液,所得气体干燥后体积为V2升(标准状况)。再用Na2S2O3溶液逐滴滴定测KI溶液中的I2,反应如下:
O3+2KI+H2O=O2+I2+2HOH
Cl2+2KI=I2+2KCl
I2+2Na2S2O3=2NaI+Na2S4O6
若V1=1.00升,V2=0.98升,滴定时消耗0.10mol/L的Na2S2O3溶液0.0267升,求氯酸钾受热分解得到的气体里Cl2和O3的体积分数。
【提示】:氯气=0.摩尔,臭氧=0.摩尔
12.
在亚硝酸钠(NaNO2)中氮元素的化合价为+3价,为证明和研究亚硝酸钠的性质,现有以下几种试剂可供选择:
①KMnO4溶液 ②稀H2SO4溶液 ③稀HNO3溶液 ④稀NaOH溶液 ⑤淀粉、KI溶液 ⑥品红溶液
试用上述试剂回答下列各问:
(1)证明NaNO2具有氧化性应选择的试剂是 ,发生反应的离子方程式是
。
(2)证明NaNO2具有还原性应选择的试剂是 ,发生反应的离子方程式是
。
(3)在NaNO2溶液中加入稀硫酸时,溶液呈现浅蓝色,这说明生成的新物质是
,表示这一反应的化学方程式是
。
【提示】:(3)生成的新物质是N2O3,弄清这一点是解题的关键所在!
13.
1971年,斯图杰尔和阿佩里曼成功地合成了次氟酸。他们是在0℃以下将氟从细冰末上面通过,得到毫克量的次氟酸。已知次氟酸的分子组成与次氯酸类似,分子中原子间亦以共价键结合。
(1)写出次氟酸的结构式【答:H-O-F】
(2)写出上述制取次氟酸的化学方程式【答:F2+H2O=HFO+HF】
(3)次氟酸根很不稳定,试预测其受热分解的可能途征,用化学方程式表示【答:2HFO=2HF+O2】
(4)次氟酸在刹那间能完成与热水的反应,此时得到的溶液,既表现氧化性(对于I-),又表现有还原性(对于MnO![]() ),可推测次氟酸与热水反应的产物中含有【答:H2O2】
),可推测次氟酸与热水反应的产物中含有【答:H2O2】
14.
![]() 燃烧时除了生成水以外,还可生成少量的
燃烧时除了生成水以外,还可生成少量的![]() ,但一般条件下很得到
,但一般条件下很得到![]() 。如果将
。如果将![]() 燃烧时产生的火焰用冰块冷却,就可检验出有极少量的
燃烧时产生的火焰用冰块冷却,就可检验出有极少量的![]() 生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
I、一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1mol/LKI-淀粉溶液,不显蓝色。
II、另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1mol/LKI-淀粉溶液,立即成蓝色。
试回答:
(1)为什么一般条件下得不到![]() ?
?
【答:![]() 不稳定,遇热易分解】
不稳定,遇热易分解】
(2)为什么要做对比实验I?
【答:排除冰块熔化后所得的液体也能使KI-淀粉溶液变蓝的可能】
(3)为了增强实验效果,且能迅速检出反应过程中生成的![]() ,在不另加任何试剂和用品的情况下,你认为如何改进为好?
,在不另加任何试剂和用品的情况下,你认为如何改进为好?
【答:在蒸发皿中先加入KI-淀粉溶液,用氢氧焰直接对着冰块加热】
(4)可否将实验II中的淀粉换成酚酞试液?为什么?
【答:不可以,因为在中性环境中,![]() 不可能生成
不可能生成![]() 】
】
15.
计 算 题
1.
为了测定血液中钙离子的含量,取5毫升血液样品,稀释成50毫升,从中取出10毫升,加入过量草酸钾(K2C2O4)溶液,使钙离子完全转化成草酸钙沉淀。滤出并洗净所得草酸钙沉淀,用过量稀硫酸溶解,生成草酸和硫酸钙稀溶液。往溶液中加入10毫升0.0020mol/L的KMnO4溶液,使草酸完全被氧化,再用FeSO4溶液滴定过量的KMnO4溶液,当KMnO4溶液的紫红色刚好褪去时,耗0.10mol/L的FeSO4溶液8.9毫升。已知KMnO4溶液和草酸、FeSO4溶液的反应可表示为(未配平):
MnO![]() +H2C2O4+H+®CO2+Mn2++H2O
+H2C2O4+H+®CO2+Mn2++H2O
MnO![]() +Fe2++H+®Fe3++Mn2++H2O
+Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。
【解】:将有关反应式配平:
2MnO![]() +2H2C2O4+6H+®10CO2+2Mn2++8H2O
+2H2C2O4+6H+®10CO2+2Mn2++8H2O
MnO![]() +5Fe2++8H+®5Fe3++Mn2++4H2O
+5Fe2++8H+®5Fe3++Mn2++4H2O
得反应关系式为:Ca2+~CaC2O4~H2C2O4
跟H2C2O4反应的KMnO4的量=0.0020×10×10-3-0.010×8.9×10-3×![]() =2.2×10-6(摩)
=2.2×10-6(摩)
H2C2O4的量=2.2×10-6×![]() =5.5×10-6(摩)
=5.5×10-6(摩)
100毫升血样中的钙离子质量=5.5×10-5×40×![]() ×
×![]() =0.022克
=0.022克
2.
0.04摩KMnO4固体,加热一段时间后,收集到a摩气体,在反应后的留固体中加入足量的浓盐酸,又收集到b摩气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为【答:0.08≤a+b<0.1】
(2)计算若a+b=0.09摩时,残留固体的质量为多少克?【答:6克】
〖提示〗:2KMnO4
=K2MnO4+MnO2+O2
2a摩 a摩 a摩 a摩
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
0.04-2a ![]()
K2MnO4+8HCl=2KCl+2MnCl2+2Cl2+4H2O
a 2a
MnO2+4HCl=MnCl2+Cl2+2H2O
a a
可知:b=2a+a+![]() =(0.1-2a)
=(0.1-2a)
因为a+b=a+(0.1-2a)=0.09,解得a=0.01摩
则O2质量为0.01×32=0.32克,残留固体质量为0.04×158-0.32=6克。