中学化学习题汇编《卤素》基础部分
选 择 题
1.下列微粒或物质中,化学性质最活泼的是-------------------------------------(B)
A.氯气分子 B.氯原子 C.氯离子 D.液氯
2.在盛有碘水的试管中,加入少量四氯化碳后振荡,静置片刻后-----------(C)
A.整个溶液变紫色 B. 整个溶液变棕色
C.上层无色,下层紫红色 D.下层无色,上层紫红色
3.为了防止污染,下列各组物质不能同时倒入废液缸内的有----------------(D)
A.盐酸和碳酸钠溶液 B.硫酸钾溶液和氯化钡溶液
C.氯化钾溶液和氢碘酸 D.高锰酸钾溶液和盐酸
4.若用X代表F、Cl、Br、I四种卤族元素,下列属于它们共性反应的是-------------------------------------------------------------------------------------------------(A)
A.X2+H2 == 2HX B.X2+H2O == HX+HXO
C.2Fe+3X2 == 2FeX3 D.X2+2NaOH == NaX+NaXO+H2O
5.在NaBr和KI的混和溶液中通入过量的氯气,然后将溶液蒸干并灼燃,最后留下的物质是-----------------------------------------------------------------------------(D)
A.NaCl B.NaCl和KBr C .KCl和NaBr D.NaCl和KCl
6.元素从化合物中被置换成单质时,该元素--------------------------------------(C)
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原 D.既不被氧化,也不被还原
7. 饱和氯水长期放置后,下列微粒在溶液中不减少的是-----------------〖C〗
A.Cl2 B.HClO C.Cl- D.H2O
8.在通常情况下, 下列各组物质不能共存的是------------------------------ -(B)
A.氯气和氢气 B.氟气和氢气
C.溴和氢气 D.氯化氢和溴化氢
9.向KI溶液中加入AgNO3溶液,直到刚好完全反应为止,所得溶液的质量恰好等于原碘化钾溶液的质量,则AgNO3溶液的质量百分比浓度是--------(B)
A.27.7% B.72.3% C.70.6% D.29.4%
10.将某种金属卤化物和浓硫酸在烧杯里加热后,可得到无色卤化氢气体,则该金属卤化物是----------------------------------------------------------------------(B)
A.氟化物 B.氯化物 C.溴化物 D.碘 化物
11.下列关于氯水的叙述,不正确的是------------------------------------------(AC)
A.新制氯水中只含Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置后溶液的酸性增强
12.下列物质的保存方法,正确的是----------------------------------------------(AC)
A.保存液溴时,加少量水密封 B.氢氟酸保存在棕色试剂瓶中
C.液氯密闭保存在钢瓶中 D.碘通常保存在无色试剂瓶中
13.氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争;当这种毒气弹顺风爆炸时,通常可采用的防御办法是----------------------------------------------------(CD)
A.人、蓄应躲到低洼的地方去 B.人、蓄多饮豆浆和牛乳
C. 人、蓄应躲到较高的地方去 D.可用肥皂水浸湿软布蒙面
14.为了获得不含氯化氢的干燥氯气,正确的净化次序是--------------------(C)
A.第一步通过浓硫酸,第二步通过无水氯化钙
B.第一步通过水,第二步通过氧化钙
C.第一步通过饱和食盐水, 第二步通过无水氯化钙
D. 第一步通过碱石灰,第二步通过浓硫酸
15.在AgNO3溶液里加入足量的氯化钠溶液后,再加入碘化钾溶液,结果会有黄色沉淀产生,这是因为-----------------------------------------------------------(B)
A.Ag+与Cl-结合不如Ag与I-结合快
B.AgI比AgCl更难溶于水
C.AgCl比AgI容易分解
D.Cl的氧化性比I强,而还原性I-比Cl-强
〖提示〗:不涉及到氧化—还原反应,所以D不是正确答案之一
16.固体NaBr和浓硫酸混和微热,其生成物是----------------------------------(D)
A.HBr、H2O、SO2 B.HBr、Na2SO4、H2O
C.Br2、SO2、NaHSO4 D.Br2、SO2、NaHSO4、H2O
17.一瓶无色气体,可能含氯化氢、硫化氢、二氧化硫、二氧化氮、溴化氢、二氧化碳中的一种或几种;将其通入氯水中,得无色透明溶液,将该溶液分成两份,一份加入盐酸酸化的氯化钡溶液,析出白色沉淀;另一份加入硝酸酸化的硝酸银溶液,也有白色沉淀产生。下面结论正确的是------------------------------(A)
①原气体中肯定有二氧化硫 ②原气体中可能有二氧化硫 ③原气体中肯定无硫化氢、 溴化氢、二氧化氮 ④不能肯定是否含有氯化氢 ⑤原气体中肯定不含二氧化碳 ⑥原气体中肯定含有氯化氢
A.①③④ B.①④⑤ C.①③⑥ D.①③④⑤⑥
18.有甲、乙、丙、丁四只集气瓶中分别装有Cl2、H2、HCl、HBr中的一种气体,甲、丁两瓶气体混和后见光会发生爆炸,甲、乙两瓶混和后,瓶壁上可见暗红色小液滴。则乙瓶中的气体是---------------------------------------------(A)
A. HBr B.HCl C.H2 D.Cl2
19.在一定条件下会发生下列反应:
①4HCl+O2 == 2H2O+2Cl2 ②氯气溶于水:Cl2+H2O == HCl+HClO
③氟气与水反应:2F2+2H2O == 4HF+O2
由以上反应可以判断出氢化物的稳定性-----------------------------------------(A)
A. H2O > HCl B. H2O >HF C. HCl> H2O D.无法判断
20.现有下列三个反应:
①2FeCl3+2KI == 2FeCl2+2KCl+I2
②2FeCl2+Cl2 == 2FeCl3
③2KMnO4+16HCl == 2KCl+2MnCl2+5Cl2+8H2O
若FeCl2溶液中含有I-杂质,要氧化除去I-杂质可加入的试剂是----------------(D)
A. Cl2 B.盐酸 C. KMnO4 D. FeCl3
21.两种金属组成的合金50克,与足量氯气反应,共用去氯气71克,则该合金可能的组成是---------------------------------------------------------------------(B)
A.锌和铜 B.钙和铜 C.钠和铝 D.铝和铁
22.取一定量的二氧化锰和氯酸钾的混和物加热,完全反应后,将剩余的固体与足量的浓盐酸混和加热,待反应完毕后将溶液蒸干,所得固体的质量与原混和物的质量相等,则原混和物中KClO3的质量百分数是---------------------(C)
A.87.5% B.46.65% C.53.36% D.58.47%
23.浓度为2摩/升的氢溴酸溶液V升,欲使其浓度变为4摩/升,以下列出的方法中,可行的是---------------------------------------------------------------------(D)
A.通入标况下的HBr气体44.8升
B.将溶液加热蒸发浓缩至0.5V
C.蒸发掉0.5升水
D.加入10摩/升氢溴酸0.6V升,再将溶液稀释至2V升
24.下列所指物质是纯净物的是----------------------------------------------------(D)
A.红磷在氯气中燃烧所得到的产物 B.从市场上购得的漂白粉
C.实验室用KMnO4固体 和浓盐酸反应,从气体发生装置中导出的气体
D.氟气与氢气等物质的量混和后置于阴凉处片刻之后
25.环卫工作人员夏天向马路洒水时,常常在洒水车中的水里加入适量的-(B)
A.NaCl B.CaCl2 C.NaOH D.CaO
26.为了除去氯气中少量的水蒸气,可使含有杂质的氯气通过某特定的干燥管,此干燥管中装有下列药品中的-------------------------------------------------(A)
A.五氧化二磷粉未 B.浓硫酸 C.饱和食盐水 D.碱石灰
〖提示〗:干燥管中装的是固体干燥剂
27.氯化钡溶液32.33克恰好与20克硫酸溶液完全反应,滤出沉淀后得到50克盐酸,该盐酸的质量分数应是--------------------------------(D)
A.0.374% B.0.292% C.0.73% D.1.46%
〖提示〗:两种溶液的质量之和为52.33克,最后得到溶液50克,这说明生成的沉淀为2.33克,也就是0.01摩,则生成的HCl为0.02摩。
28.为了除去氯气中混有的少量水蒸气,可使含杂质的氯气通过某特定的干燥管,此干燥管中装有下列药品中的------------------------------------------(A)
A.五氧化二磷粉未 B.浓硫酸 C.饱和食盐水 D.碱石灰
〖提示〗:干燥管中只能放置固体干燥剂,所以B不能成为答案
29.下列溶液中含有能自由移动的离子的是------------------------------------(BD)
A.氯酸钾溶液 B.氯化钾溶液
C.液态氯化氢 D.熔融的氯化钠
30.下列反应可用化学方程式SO2+Br2+2H2O == H2SO4+2HBr表示的有---(D)
①把SO2气体通入溴水中 ②把液溴加入到SO2的水溶液中 ③把硫酸与Na2SO3反应得到的气体通入溴水中 ④把浓硫酸与溴化氢混和加热得到的红色气体通入水中
A.①②④ B.①③④ C.①②③ D.①②③④
31.做氯化氢的喷泉实验后,烧瓶内的液体只占烧瓶容积的![]() ,其原因可能是-----------------------------------------------------------------------------------------(BC)
,其原因可能是-----------------------------------------------------------------------------------------(BC)
A.HCl气体没有完全溶解 B.装置漏气,进入空气
C.集气时有空气混入 D.胶头滴管挤入烧瓶的水太少
32.把9.5克氟气通入90.5克水中,设这些氟气全部被水所吸收,可测得该溶液的质量百分比浓度为-------------------------------------------------------------(C)
A.9.5% B.1% C.10.4% D.16.4%
33.有W、X、Y三种气体是Cl2、HCl、HBr,但不知分别是哪种;已知W、X混和后无反应,则正确的判断是-----------------------------------------(AB)
A.Y肯定不是HCl B.W、X不能确定
C.Y可能是HCl D.Y不是Cl2,也不是HBr
34.现有7.9克锰的氧化物跟足量的浓盐酸反应,共收集到Cl23.55克,则该反应为--(A)
A.Mn2O3+6HCl == 2MnCl2+3H2O+Cl2
B.Mn3O4+8HCl == 3MnCl2+4H2O+Cl2
C.MnO2+4HCl == MnCl2+2H2O+Cl2
D.Mn2O7+14HCl == 2MnCl2+7H2O+5Cl2
〖提示〗:当生成氯的物质的量为1摩时, MnxOy的质量应为158克。
35.下列说法中正确的是---------------------------------------------------------------(C)
A.强氧化剂和弱还原剂易发生氧化—还原反应
B.实验室制氯气的反应中,氯离子通过还原反应生成氯气
C.由HgCl2生成Hg2Cl2时,汞元素被还原了
D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强
〖提示〗:卤素离子没有氧化性,因为它们的化合价不能再降低了;同样,碱金属离子等金属离子也不会有还原性,因为它们的化合价不可能再提高了。
36.为了探索月球上是否存在生命的痕迹,首先要分析月球岩中是否包藏有碳氢化合物。科学家用氘盐酸即DCl的D2O溶液处理岩石样品,收集放出的气体加以分析,结果只发现有一些气态碳氘化合物。试推断该碳氘化合物是 (C)
A.岩石中的碳酸盐与氘盐酸反应的产物
B.岩石中的碳酸氢盐与氘盐酸反应的产物
C.岩石中的碳化物(如碳化钙等)与氘盐酸反应的产物
D.岩石中的碳氢化合物与氘盐酸反应的产物
37.取相同体积的KI、Na2S和FeBr2溶液分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比为---------------------------------------------------------------------------(C)
A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1
38.碘缺乏病是目前已知的导致人类智力障碍的主要因素,为解决这一全国性的问题,我国实施“智力工程”最经济可行的措施是------------------------------(A)
A.食盐中添加碘盐 B.面包中加碘盐
C.大量食用海带 D.注射含碘药剂
39.已知粗碘中含有ICl(氯化碘)和IBr(溴化碘),它们的性质与卤素单质的性质相似。用升华法提纯碘时,为了将这些杂质除去,可加入适量的有关物质进行预处理。加入的物质是下列中的-------------------------------------------------(D)
A.碘 B.液氯 C.氟化钾 D.碘化钾
40.某金属氯化物中含氯34%,该金属为+2价,则该金属为-------------(D)
A.Ca B.M克 C.Zn D.Ba
41.液态溴中混有少量的氯气同时溶解在四氯化碳中,欲除掉杂质氯气,可向其中--------------------------------------------------------------------------------------(B)
A.加适量碘化钾溶液振荡 B.加适量溴化钾溶液振荡
C.加适量氯化钠溶液振荡 D.通入适量氯气
42.鉴别氯水和盐酸两种物质时,最合适的试剂是-------------------------------(B)
A.硝酸银溶液 B.碘化钾淀粉溶液
C.碳酸钠溶液 D.酚酞溶液
43.有两种卤单质共1摩尔,跟氢气在一定条件下完全反应后,生成的卤化氢的平均分子量是38.5,则这两种卤素单质不可能是------------------------(AD)
A.F2、Cl2 B.F2、Br2 C.Cl2、Br2 D.Br2、I2
44.有13.6克氯化锌样品(其中混有另一种氯化物),将样品溶于水后加足量的硝酸银溶液,可得沉淀29.5克,则样品中可能含有下列哪一种氯化物---(BC)
A.氯化汞 B.氯化铝 C.氯化镁 D.氯化钡
45.将5.85克NaCl与浓硫酸加热制得HCl气体2.24升(STP),则所用98%的浓硫酸的质量为-----------------------------------------------------------------〖C〗
A.3克 B.5克 C.大于5克 D.以上都不是
〖提示〗:反应过程中硫酸的浓度不断降低,稀硫酸不会跟氯化钠反应。
46.将足量的二氧化锰与40毫升10摩/升浓盐酸反应产生的氯气同0.1摩二氧化锰与足量的浓盐酸反应产生的氯气相比------------------------------------〖C〗
A.前者产生的氯气多 B.一样多
C.后者产生的氯气多 D.无法比较
47.向溴化钠、碘化钠的混合液中通入足量的氯气,再加热将溶液蒸干并灼烧片刻,最后残留的物质是----------------------------------------------------------〖A〗
A.NaCl B.NaCl,I2 C.NaCl,Br2,I2 D.NaCl,NaBr,NaI
48.
49.
填 空 题
1.某化学课外小组用海带为原料制取少量碘水。现用四氯化碳从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分为以下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50毫升碘水和15毫升四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检验分液斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液
F.从分液漏斗上口倒出上层水溶液
G.将漏斗上口的玻璃塞打开或使上凹槽或小孔对准漏斗口上的小孔
H.静置,分层
就此实验,完成下列问题:
(1)正确操作步聚的顺序是(用上述操作的字母编号填写):
【答】:C®B®D®A®G®H®E®F
(2)上述E步的操作中应注意:
【答】:分液漏斗的下端紧靠烧杯内壁,及时关闭旋塞
(3)选用四氯化碳从碘水中萃取碘的原因是:
【答】:四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发
2.有六种无色溶液,已知它们分别是Na2CO3、Na2SO4、NaClO、KI、BaCl2和HCl的溶液,要求不用试剂把它们鉴别出来。为了鉴别它们各贴以标签a、b、c、d、e、f,然后进行下列实验,实验现象记录如下:
| 实验编号 | (1) | (2) | (3) | (4) | (5) |
| 操 作 | a+b | a+e | b+c | b+d | d+f |
| 反应现象 | 产生白色沉淀 | 有气体产生 | 产生白色沉淀 | 产生白色沉淀 | 溶液呈黄色 |
注:Ba(ClO)2是白色沉淀,ClO-能使I-氧化
试判断a、b、c、d、e、f各是那种溶液?
【答】: a—Na2CO3 b—BaCl2 c—Na2SO4 d—NaClO
e—HCl f—KI
39.将一定量的氯气通入250毫升溴化钾溶液中然后将所得溶液蒸干,得干燥固体40克,经分析知其中含25%的化合态的溴(质量)。试计算:
(1)通入氯气的质量【答:11.97克】
(2)原溴化钾溶液的百分比浓度(设溴化钾溶液的密度为1克/厘米3【答:22%】
40.已知AgCl和AgBr的混和物中含Ag61%,试求混和物中溴元素的质量百分含量【答: 34%】
41.有一KCl和KBr的样品共3.87克,溶于水配成溶液,向溶液中加入过量AgNO3溶液,充分反应后,产生沉淀质量为6.63克,则原样品中钾元素的质量百分含量为【答: 40.3%】
42.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
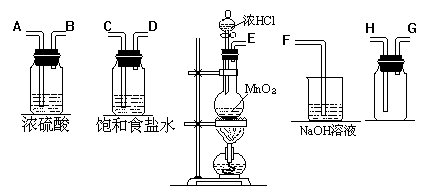
(1)连接上述仪器的正确顺序是(填各接口处的字母):
__▲__接_▲__,__▲_接_▲__,_▲__接__▲__,_▲_接__▲__。
(2)在装置中①饱和食盐水起的作用是_▲_,②浓硫酸起的作用是_▲_。
(3)写出下列化学反应的离子方程式:气体发生装置中进行的反应_▲_。
43.
计 算 题
1.甲、乙两学生用加热氯酸钾的方法制取氧气。甲取一定量氯酸钾和0.10克二氧化锰,经混和后装入试管内加热,待收集到所需氧气时停止。试管冷却后,乙称得甲留下的反应混和物的质量为4.04克,将它继续加热直至其中的氯酸钾完全分解,收集到氧气0.96克,求甲实验时氯酸钾的分解。
〖提示〗:先从乙实验中放出的0.96克氧气求出甲留下的氯酸钾为2.45克,则甲留下的4.04克固体应是二氧化锰(0.10克)、未分解的氯酸钾(2.45克)、由甲实验时生成的氯化钾(4.04-0.10-2.45克);再从甲实验中生成的氯化钾的质量(1.49克)可求出甲在实验中有2.45克氯酸钾分解,则原混和物中氯酸钾的总质量为4.90克,所以甲实验中氯酸钾的分解率为![]() =50%
=50%
2.将氯元素与溴元素组成的卤素互化物BrCln4.66克溶于水,再通入过量的二氧化硫,使其发生如下反应:
BrCln
+ (n+1) H2O+![]() SO2 = HBr+nHCl+
SO2 = HBr+nHCl+![]() H2SO4
H2SO4
然后向生成的溶液中加入过量的硝酸钡溶液,除去生成的沉淀后,将所得滤液用过量的硝酸银溶液处理,可生成沉淀15.46克,试确定n的值。
〖提示〗: BrCln ~ AgBr+nAgCl
80+35.5n 188+143.5n
4.66 15.46 可解得 n=3
3.某含杂质氯化钾的氯酸钾样品,经分析得知其中含有氯元素的质量分数为35.5%,求氯酸钾的纯度。【答:65.1%】
〖提示〗:因为样品中KClO3中只含有杂质KCl,其中均含有“KCl”的成分,故我们可以先假设样品是由“KCl”和“O”组成的,求出“KCl”的质量分数为74.5%,则“O”的质量分数为1-74.5%=25.5%。
样品中KClO3的质量分数可由下式求得:
KClO3 ~ 3O
122.5
48
?=65.1% 25.5%
4.NaCl,NaBr,NaI三种溶液可用一种试剂将它们鉴别出来,这种试剂是【答:氯气或硝酸银】 。往含有1.6g溴化钾的溶液中加入含有杂质氯的粗溴6.0g,将混和物蒸发,烘干得残留物1.3g,则粗溴中氯的质量分数是【答:4%】。
〖提示〗:2KBr+Cl2
== 2KCl+Br2
DW
238
71 149
89
?=0.24
0.3
%=![]() =4%
=4%