高三级化学11月考试试题
化学测试卷
命题:linyikun
说明:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷1—4页,第II卷5—8页。将第I卷的正确选项写在机读卡上,第II卷用钢笔或圆珠笔直接答在试题卷上。
2.本试卷满分108分,90分钟完卷。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第I卷(选择题 共48分)
一、选择题(本题包括12小题,每小题4分,共48分。每小题只有一个选项符合题意)
1.下列说法正确的是
A.在外加电场的作用下,胶体发生电泳现象,说明胶体是带电荷的
B.水的沸点比硫化氢的沸点高,是因为水分子内形成了氢键
C.晶体中有阴离子就一定有阳离子
D.有单质参加或生成的反应一定是氧化还原反应
2.pH与体积均相同的氢氧化钠溶液和氨水,分别与同浓度、同体积的AlCl3溶液反应,生成沉淀的质量也相同,则可能是
A.AlCl3过量 B.AlCl3的量恰好与氢氧化钠完全反应
C.两种碱均过量 D.AlCl3的量恰好与氨水完全反应
3.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和![]() ,则反应的S和生成的S2-、
,则反应的S和生成的S2-、![]() 的物质的量之比为
的物质的量之比为
A.2 :1 :1 B.3 :2 :1 C.3 :1 :2 D.4 :1 :3
4.NA代表阿伏加德罗常数的值,下列说法正确的是
A.在标准状况下,VL水含有的氧原子个数为![]() NA
NA
B.CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44个
C.常温下,1L 1 mol·L-1的乙酸溶液中,所含CH3COO—为NA
D.常温常压下,0.1 mol氖气含有的电子数为NA
5.某无色透明溶液能与铝反应放出H2,则该溶液中可大量共存的离子是
A.OH- Mg2+ ![]() Cl- B.Cl- K+ Na+ Ba2+
Cl- B.Cl- K+ Na+ Ba2+
C.Ba2+ Cl- Cu2+ ![]() D.H+ Na+
D.H+ Na+ ![]() Cl-
Cl-
6.向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是
①![]() ②
②![]() ③OH- ④Fe2+
③OH- ④Fe2+
A.①② B.③④ C.①②③ D.①②③④
7 .MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,则下列有关该电池的说法正确的是
A.该电池负极的反应为:H2+CO32--2e-=H2O+CO2
B.该电池的正极的反应式为:4OH—+4e—=O2+2H2O
C.放电时CO32—向正极移动
D.随着反应的进行,CO32—在不断消耗
8.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
| X | |||
| Y | Z | ||
| W | |||
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①② C.①②③ D.①②③④
![]() 9.一定条件下,可逆反应C(s)
+ CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
9.一定条件下,可逆反应C(s)
+ CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
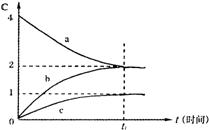
|
变化情况如下图所示。由图分析不能得出的结论是
| |
B.t1后,若升高温度,正反应速率增大
C.t1后,若升高温度,a的转化率增大
D.t1后,若增大压强,混合气体的平均相对分子质量增大
11.25℃时,pH=2某酸(HA)与pH=12某碱(BOH)等体积混合后,混合液的pH=10,
下列描述中正确的是
A.若两者中有一种为强电解质,则一定是BOH
B.若HA是强酸,混合液中离子浓度关系一定是![]()
C.若混合液中存在离子水解,则一定是A-水解
D.两者混合后,BOH有可能过量
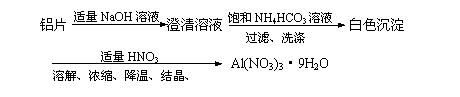 12.实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
12.实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
| |
A.2Al+2OH-+2H2O = 2AlO2-+3H2↑
B.2HCO3-+2AlO2-+H2O = 2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O = NH3·H2O+ Al(OH)3↓
D.3H++ Al(OH)3 = Al3++3H2O
化学测试卷
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 总 分 |
第II卷(非选择题 共60分)
 13.(共9分)
13.(共9分)
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)某同学提出的假设是:
;
(2)通过实验Ⅰ可以证明: ;
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:
在Ⅲ中先加入 ,再加入 。
(4)探究结果为: 。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
13.(共9分)
(1)H2O、H+、SO42-中的某一种粒子能够使CuO溶解(2分)
(2)水不能使氧化铜溶解,而是另外的H+、SO42-两种粒子中的一种粒子使CuO溶解(2分)
(3)Na2SO4(或K2SO4等)(1分),稀硫酸(1分)
(4)氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O,SO42-两种粒子都不能使CuO溶解。(2分) 硝酸或盐酸等 (1分)
14.(9分)
某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发同耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1 535 |
| 沸点(℃0 | 2 467 | 2 750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含物中含有金属铝。请填写下列表格:
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
14.(9分)
(1)合理(1分)
(2)用磁铁吸引,若能吸附,说明有铁生成(2分,只回答用磁铁吸引,给1分;其它答案合理且完全正确给1分)
(3)NaOH溶液(1分) 取少量样品放入试管,加入NaOH溶液,(1分)若有气泡产生,说明该熔融物中有铝(1分)
2Al+2NaOH+6H2O 2Na[Al(OH)3]+3H2↑(3分)
15.(9分)
恒温、恒压(1.01×105Pa)下,将2.0molSO2与a molO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
![]() 2SO2(g)+O2(g)
2SO3(g);△H<0
2SO2(g)+O2(g)
2SO3(g);△H<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,
则a= ;平衡时SO2的转化率为 。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。
T1与T2的关系是: (选填序号)。
①.T1>T2 ②.T1<T2 ③.T1=T2
15.(6分)
(1)3.65;65% (2)①
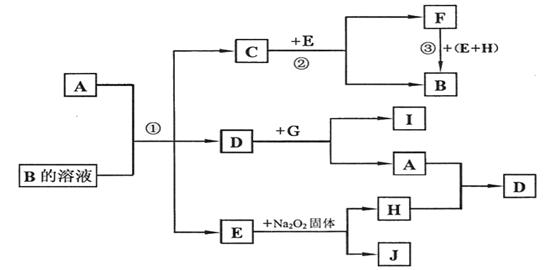
16.(14分)
|
请回答下列问题:
(1)物质C、E的化学式分别为 ; 。
(2)物质D的结构式为 ;G可能的化学式为 。
(3)反应①②③的化学方程式分别为(需条件的,要注明反应条件):
① ;
② ;
③ 。
(4)将金属铝片和A的某种同素异形体作电极,一定浓度的J的水溶液作电解质溶液构成原电池,则原电池的负极的电极反应为:
;
原电池总反应的离子方程式为:
。
16.(14分)
(1)NO2(1分) H2O(1分)
|
(3)①4HNO3(浓)+C CO2↑+4NO2↑+2H2O(2分)
②3NO2+H2O 2HNO3+NO(2分)
③4NO+3O2+2H2O 4HNO3(2分)
(4)Al+4OH—-3e— AlO![]() +2H2O(2分) 2Al+2OH—+2H2O
+2H2O(2分) 2Al+2OH—+2H2O 2AlO![]() +3H2↑(2分)
+3H2↑(2分)
17.(8分)
X、Y、Z为前三周期元素形成的微粒,它们的电子总数相等。已知X为负二价双原子阴离子;Y为双原子分子;Z常温为液体,其水溶液呈弱酸性。
(1)X与钠离子组成的离子化合物常温下跟水反应产生一种可助燃的气体,该反应的化学方程式为:
。
(2)若Y为遇水就能剧烈反应的单质,则Y的电子式为 ;
若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为:
。
(3)若在稀硫酸中加入铜粉后再加Z,发现铜粉逐渐溶解,该反应的离子方程式为:
。
17.(8分)
|
(2): F : F : (2分)
2HCl H2↑+Cl2↑(2分)
(3)Cu+H2O2+2H+ Cu2++2H2O(2分)
18.(11分)
有NaOH和NaHCO3的混合物。(要求:计算结果均保留三位有效数字)
(1)取10.4g该混合物与足量的盐酸反应。若收集到气体V L(标准状况),则原混合物中NaOH的质量分数ω(NaOH)= 。(只写表达式,可不化简)
(2)取10.4g该混合物与100mL1.00mol/L的盐酸充分反应后,若收集到气体1.12L(标准状况),则原混合物中:n (NaOH)= ; m (NaHCO3)= .
(3)设该混合物中n(NaOH)/n(NaHCO3)=x,取该化合物10.4g于一容器内充分加热后,再排出气体,固体质量减少了m.试通过计算确定m的取值:
①x≥1时,m = ;
②x<1时,m = .
答案
1 .C 2 .B 3 .B 4.D 5. B 6.D 7.A 8.C 9.B 10.C 11.D 12.B
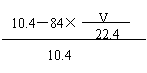 18.(1)
(3分) (2)0.0500mol; 8.40g (3) ①≤1.51g ②>1.51g
18.(1)
(3分) (2)0.0500mol; 8.40g (3) ①≤1.51g ②>1.51g
(各2分)