福州第一中学第二学期高三理综训练试卷(4)
理科综合试卷
相对原子质量:C——12 H——1 Mg——24 Al——27 Ag——108 Cu——64 Zn——65 Fe——56 S——32 Na——23
时间:150分钟 满分300分
第Ⅰ卷(选择题,共126分)
一、选择题(每小题6分)
1.动物体能量的输入和输出具有如下关系:能量输入=能量输出+能量贮存,以下有关叙述中不正确的是
A.若能量的输入大于输出,则表现为体重增加
B.输出的能量等于产生的热能与生命活动所消耗的能量之和
C.若能量的输入等于输出,则机体消耗自身物质产生热能
 D.在禁食和安静状态下能量输入为零,则体重减轻
D.在禁食和安静状态下能量输入为零,则体重减轻
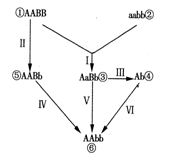
2. 下图表示用某种农作物品种①和②两个品系培育出可用于生产的品种⑥的可能方法,其中成功率较高且育种年限较短的培育途径是:
A、Ⅱ→Ⅳ B、Ⅰ→Ⅴ
C、Ⅰ→Ⅲ→Ⅵ D、Ⅱ→Ⅳ和Ⅰ→Ⅴ
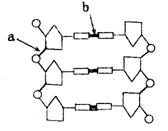 3.对右图有关工具酶功能的叙述,不正确的是
3.对右图有关工具酶功能的叙述,不正确的是
A.切断a处的酶为限制性内切酶
B.连接a处的酶为DNA连接酶
C.切断b处的酶为解旋酶
D.连接b处的酶为DNA连接酶
4.在不列颠哥伦比亚山上发现一小群Satquatches羊。对发生在这个羊群中的四次交配进行了几年的研究,其结果列于下表。事实上只有五个亲本参与这些交配,请选出这五个个体的基因型。(分别用A、a和B、b表示两对等位基因)
| 交 配 | 亲本号1 | 亲本号2 | 后 代 |
| 1 | 弓腿,毛膝 | 弓腿,毛膝 | 3/4弓腿,毛膝、1/4内翻膝,毛膝 |
| 2 | 弓腿,无毛膝 | 内翻膝,无毛膝 | 1/2弓腿,无毛膝、1/2内翻膝,无毛膝 |
| 3 | 弓腿,毛膝 | 内翻膝,无毛膝 | 1/4弓腿,无毛膝、1/4弓腿,毛膝、 1/4内翻膝,毛膝、1/4内翻膝,无毛膝 |
| 4 | 弓腿,毛膝 | 弓腿,毛膝 | 3/4弓腿,毛膝、1/4弓腿,无毛膝 |
A.AaBB、AABb、aaBB、Aabb、aabb B.AaBB、AABb、AaBb、Aabb、aabb
 C.AaBb、AABb、AAbb、aabb、Aabb D.AaBB、AABb、aabb、AABB、Aabb
C.AaBb、AABb、AAbb、aabb、Aabb D.AaBB、AABb、aabb、AABB、Aabb
5.右图是根据细胞器的相似或不同点进行分类的。下列选项中不是此图分类依据的是
A.有无膜结构 B.单层膜还是双层膜
C.是否含有色素 D.是否普遍存在于动植物细胞中
6.有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
7.下列说法正确的是
A.pH=3硝酸和pH=2的醋酸中c(H+)之比为1∶10
B.Na2CO3溶液c(Na+)与c(CO![]() )之比为2∶1
)之比为2∶1
C.0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2∶1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3∶1
8.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍。由这三种元素组成的化合物的化学式不可能是
A.A3BC4 B.A2(BC4)3 C.A2BC3 D.ABC4
9.用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.在反应CaO+3C高温CaC2+CO↑中生成1molCO,电子转移数为3 NA
B.常温时,2L1mol/L的甲酸溶液中,所含分子总数小于2NA
C.1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
D.1molNH2—中含电子数为10 NA
10.将x molCO和y mol H2的混合气体充入盛有足量Na2O2的密闭容器中,再通入z molO2,并用电火花使其充分反应,有关容器内反应的下列叙述不正确的是
A.参加反应的Na2O2的物质的量为:(x+y)mol
B.反应后容器中有O2的物质的量为:(x+y)/2mol
C.反应前后容器内压强之比(温度不变):(x+y)/z
D.反应后生成了x mol Na2CO3和2y mol NaOH
11.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中的Ca2+、CO32-和HCO3-均转化为沉淀,将反应容器中的水分蒸干,最后得到白色固体共29g,则原混合物中Na2CO3的质量为
A.5.3g B.2.65g C.10.6g D.21.2g
12.2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中氢原子种类的。下列有机物分子中,在氢核磁共振谱中只给出一种信号的是
A.CH3CH2OH B.CH3OCH3 C.CH3COOH D.CH3COOCH3
13.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得。它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙醛(HOCH2CHO)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于取代反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
14. 一个质点以v1的初速度和a1的加速度做匀加速直线运动,位移s时速度为v2;紧接着以a2的加速度做匀加速直线运动,再经过位移s时速度为v3。已知v1+ v3=2 v2,则可以判定:
A.a1=a2 B. a1>a2 C. a1<a2 D.无法比较它们的大小
15. 一定质量的理想气体(分子之间没有相互作用力),在吸收热量的过程中保持温度不变。则气体一定
A. 体积增大,内能改变 B. 体积减小,内能不变
C. 压强增大,内能改变 D. 压强减小,内能不变
|
|
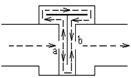
16. 内燃机、通风机等机械在排放大量气体的过程中都伴随有噪声,而消除噪声污染是环境保护的一个重要课题。如图所示是干涉型消声器的结构和气流运行图。有一列波长为λ的噪声,沿水平管道自左向右传播。当入射波到达a处时,分成两束相干波,它们分别通过r1和r2的路程到b处相遇。为了消除噪声,![]() 应当等于:
应当等于:
A.波长的整数倍 B.半波长的整数倍
C.半波长的奇数倍 D.四分之一波长的奇数倍
|
|
17.如图所示,在点电荷-Q的电场中的一条直线上,有a、b、c三点,相邻两点之间距离相等,已知a、b两点之间电势差的绝对值是U。一个带电量为-q的试探电荷从c点移到b点时:
A.电势能增加了qU B.电势能减少了qU
C.电势能增加,但增加量小于qU D.电势能减少,但减少量小于qU
|
|
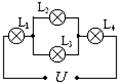
18. 右图所示的电路中,电珠L1、L2标有“6V 4W”,L3、 L4标有“6V 2W”,在电路两端加上恒定电压,各个电珠均没有被烧断。则各电珠消耗电功率
A. L1最大 B. L4最大 C. L2最小 D. L3最小
19.三木块从同一高度同时开始自由下落,其中木块甲自由落体;木块乙在刚刚开始下落时被一颗子弹沿水平方向击中并留在其中;木块丙在下落途中被一颗子弹沿水平方向击中并留在其中。不计空气阻力及子弹进入木块的时间,则:
A.三块木块同时落地 B.甲木块最先落地,乙、丙同时落地
C.木块丙最后落地,甲、乙同时落地 D.甲、乙、丙依次先后落地
20.根据爱因斯坦相对论,频率为![]() 的光子的质量
的光子的质量![]() 。将一束激光竖直向上发射,由于光子要克服重力做功,因此它的频率要减小,这种现象称为“引力红移”。则,在激光束上升高度H过程中,该光束频率的改变量
。将一束激光竖直向上发射,由于光子要克服重力做功,因此它的频率要减小,这种现象称为“引力红移”。则,在激光束上升高度H过程中,该光束频率的改变量![]() 与原来频率
与原来频率![]() 的比值为:
的比值为:
A.H/c2 B.gH/c2 C.H/gc2 D.c2/gH
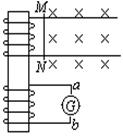
21.如图所示,由于金属棒MN在匀强磁场中沿着导轨做切割磁感线运动,而使得在电流表中产生了从a向b的感应电流。如果不计导轨及金属棒的电阻,则金属棒必须
A.向左做加速运动 B.向左做减速运动
C.向右做加速运动 D.向右做减速运动
第Ⅱ卷(非选择题,共174分)
22.
⑴在做“油膜法估测分子的大小”的实验中,使用的油酸酒精溶液的浓度是0.2%,每mL油酸酒精溶液有50滴。在盛水浅盘的水面上撒上滑石粉,再将1滴油酸酒精溶液滴入水面中央。待水面稳定后,将印有方格的玻璃板放在浅盘上,在玻璃板上描出由滑石粉围成的油膜轮廓,其形状如图所示,已知小方格边长1cm。由上述数据估测得油酸分子的直径是:_______m(结果保留一位有效数字)。
⑵某学生用打点计时器做验证机械能守恒定律的实验,在打出的若干条纸带中选中了下图所示的纸带进行测量。除起始点O外,他还选取了连续的A、B、C三点,测出这三点到O点的距离依次是:23.5cm、27.9cm和32.7cm。若重锤的质量是1kg,当地重力加速度为9.8m/s2。则重锤下落到打B点的过程中重力势能减少了_______J;打B点瞬间重锤的动能是__________J。(结果保留3位有效数字)
|
|
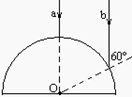
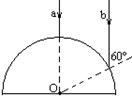 23.右图是一个玻璃半圆柱的主截面,其半径为30cm,折射率等于
23.右图是一个玻璃半圆柱的主截面,其半径为30cm,折射率等于![]() 。平行光线a、b与该半圆共面,入射角分别为0°、60°。求这两条光线在穿过半圆柱之后的交点与圆心O之间的距离。
。平行光线a、b与该半圆共面,入射角分别为0°、60°。求这两条光线在穿过半圆柱之后的交点与圆心O之间的距离。
24. 蹦床运动是运动员在一张绷紧的弹性网上蹦跳、翻滚并做各种空中动作的运动项目。一个质量为60kg的运动员,从离水平网面3.2m高处自由下落,着网后沿竖直方向蹦回到离水平网面5.0m高处。已知运动员与网接触时间为1.2s,若把在这段时间内网对运动员的作用力当作两个恒力处理:从运动员触网到速度减小为零是一个恒力,运动员由静止开始加速上升到离网是另一个恒力。求这两个恒力的大小。(g=10m/s2)
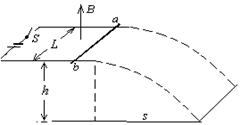 25.右图中水平放置光滑的平行金属导轨间距为L,左端跟电动势为E、内阻为r的电源串联,导轨平面距离地面的高度为h。质量为m的金属棒垂直横放在导轨上,整个装置处在竖直向上的匀强磁场中,磁感应强度为B。闭合开关,金属棒在安培力作用下向右运动并被水平抛出,落地点到导轨右端的水平距离为s。求:
25.右图中水平放置光滑的平行金属导轨间距为L,左端跟电动势为E、内阻为r的电源串联,导轨平面距离地面的高度为h。质量为m的金属棒垂直横放在导轨上,整个装置处在竖直向上的匀强磁场中,磁感应强度为B。闭合开关,金属棒在安培力作用下向右运动并被水平抛出,落地点到导轨右端的水平距离为s。求:
⑴全过程流过电路的电量;
⑵全过程在电路上释放的焦耳热。
26.(15分)当醛基直接相连的碳原子上没有氢原子时,在与强碱共热的时候,一个醛分子作为氢的供体,另一个醛分子作为氢的受体,前者被氧化,后者被还原从而发生了分子间的氧化还原反应而生成等物质的酸和醇,这样的反应叫康尼查罗反应。
![]()
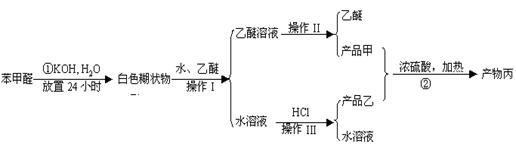 |
已知:①苯甲醛容易被空气氧化,其沸点为205.3℃;②苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g(常温);③乙醚的沸点为34.8℃;乙醚难溶于水。现实验室中用苯甲醛制备苯甲醇和苯甲酸,并用有关的物质进行反应。具体如下:
(1)混合苯甲醛、氢氧化钾和水应用的仪器是
A.带胶塞的锥形瓶 B.玻璃棒和量筒 C.烧杯 D.容量瓶
(2)操作I的名称是 ,操作II的名称为 ,操作III的名称为 。
(3)写出②发生的化学方程式
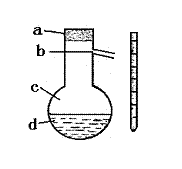 (4)在上述实验过程中,使用到右图所示仪器的操作中,温度计水银球的位置应为
(填图示a、b、c、d)。该操作中,除图中两仪器外,还需要使用到的仪器有酒精灯、带铁夹的铁架台、橡胶塞、各种导管、橡胶管以及
等必要的仪器。
(4)在上述实验过程中,使用到右图所示仪器的操作中,温度计水银球的位置应为
(填图示a、b、c、d)。该操作中,除图中两仪器外,还需要使用到的仪器有酒精灯、带铁夹的铁架台、橡胶塞、各种导管、橡胶管以及
等必要的仪器。
(5)分离产品甲的适宜温度是 。27.(15分)某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的)
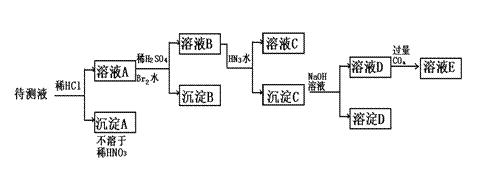
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子 (用合适的文字表达),理由 ;
(2)写出沉淀D的分子式: ;
(3)写出从溶液D生成沉淀E的反应的离子方程式: ;
 (4)溴水的作用是
。
(4)溴水的作用是
。
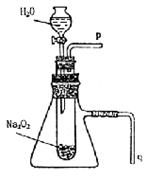
28.(15分)现行高一新教材中有一个演示实验,用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a:有氧气生成;
b: ;
(2)写出Na2O2和H2O反应的化学方程式并标明电子转移数目:
;
(3)某学校研究性学习小组拟用右图装置进行实验,以证明上述结论。
①用以验证结论a的实验操作方法及现象是: ;
②用以验证结论b的实验操作方法及现象是: ;
(4)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验以证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂: ;
现象: 。
29.请根据下列实验数据确定某水合含![]() 的盐的化学式。
的盐的化学式。
①将0.784g该含亚铁离子的盐强烈加热至质量恒定,得到0.160gFe2O3;
②将0.784g该盐溶于水,加入过量的BaCl2溶液,得到0.932gBaSO4;
③0.392g该盐溶于水,加入过量的NaOH溶液后煮沸,释放出的氨气用50.0mL 0.100mol·L-1盐酸吸收后,吸收液需要30.0mL 0.100mol·L-1 NaOH溶液恰好中和。
(1)
水合含![]() 的盐的组成元素为
;
的盐的组成元素为
;
(2) 化学式为 。
 30.下列为福州一中创新大赛的两个项目
30.下列为福州一中创新大赛的两个项目
Ⅰ、(22分)项目一:西湖水质情况和福州内河水质情况的调查
一组同学设想通过黑白瓶测氧法来测定水体的含氧量,即分别测定24 h内黑瓶(不透光)、白瓶(透光)中水样的溶解氧含量的变化,可以测定池塘中生产者光合作用所产生的氧气量,从而了解水体富营养化程度。请根据他们所准备的材料和用具,我们来回答问题。
材料和用品:溶解氧分析仪,有机玻璃采水器、标尺、大烧杯、黑白瓶等。
(1)要测定池塘中生产者光合作用所产生的氧气量,所必需测定的重要数据有四个方面?(从下列选项中选取)
① , ② 。
③______________________________; ④_______________________________.
(2)本实验的主要目的,是通过水样中的溶解氧含量的变化来测定水体中生产者的 __________________________。
(3)设置黑瓶的作用是测定_________ ______ 。
(4) 从项目的研究情况理解,我们应该把黑白瓶置于水深____________(0.2米、1米、5米)处。所得到的数值会体现西湖或内河水质情况。
(5)根据测得数据计算:24小时内呼吸消耗的氧气总量等于 __________ ;光合作用产生的氧气总量等于 ________ ;氧气净产生总量等于 _______________ 。(从下列选项中选取)
(6)请写出光合作用的化学程式
______________________________________________________
选项
A、24小时前,黑瓶中水体溶氧量 B、24小时前,白瓶中水体溶氧量
C、24小时后,黑瓶中水体溶氧量 D、24小时后,白瓶中水体溶氧量
Ⅱ.(18分)项目二:北冬虫夏草人工栽培.
⑴通过资料查询,他们了解到北冬虫夏草是寄生在一些昆虫蛹上的某种真菌。于是按如下配方制作了培养基:大米,马铃薯,白糖,牛奶粉,玉米粉,蛋白胨,维生素B1,碳酸镁,磷酸二氢钾等。并用该培养基代替 为北冬虫夏草提供养料,从培养基的成分看,属于氮源的主要是 等,生长因子是 。
⑵在培养过程中他们了解到,培养基高度不能超过玻璃瓶高度的1/6,而且当菌丝布满培养基后,需经常开盖,菌丝才能正常生长,由此推知,北冬虫夏草异化作用的类型是 。
⑶菌丝生长到一定阶段会形成子实体,这是由于细胞进行 和 的结果。子实体上长出的孢子的基因型与菌丝的基因型 。
⑷在培养过程中,发现接种量大的培养瓶中不容易感染杂菌,而接种量小的培养瓶则容易感染杂菌,从种间关系的角度分析其最可能原因是 。从种内关系的角度分析_____________________________.
班级 姓名 座号 得分
化学试卷答卷
26.(15分)
(1)_____________
(2) ___ , ______ , ____ 。
(3)
(4) (填图示a、b、c、d)。_____ 。
(5) 。
27.(15分)
(1) ___________ ,理由 ;
(2)分子式: ;
(3)方程式: ________________ ;
(4)溴水的作用是 。
28.(15分)
(1) b: ;
(2): ;
(3)①: ___________________ ;②: ___ ;
(4).试剂: ;
现象: 。
29. (1)水合含![]() 的盐的组成元素为
;
的盐的组成元素为
;
(2)化学式为 ___________________
班级 姓名 座号 得分
生物试卷答卷
 30.
30.
Ⅰ、(1)
① , ② 。
③______________________________; ④_______________________________.
(2)本实验的主要目的,是通过水样中的溶解氧含量的变化来测定水体中生产者的 __________________________。
(3)设置黑瓶的作用是测定_________ ______ 。
(4) 从项目的研究情况理解,我们应该把黑白瓶置于水深____________(0.2米、1米、5米)处。所得到的数值会体现西湖或内河水质情况。
(5)根据测得数据计算:24小时内呼吸消耗的氧气总量等于 __________ ;光合作用产生的氧气总量等于 ________ ;氧气净产生总量等于 _______________ 。(从下列选项中选取)
(6)请写出光合作用的化学程式
______________________________________________________
选项
A、24小时前,黑瓶中水体溶氧量 B、24小时前,白瓶中水体溶氧量
C、24小时后,黑瓶中水体溶氧量 D、24小时后,白瓶中水体溶氧量
Ⅱ.(18分)
⑴并用该培养基代替 为北冬虫夏草提供养料,从培养基的成分看,属于氮源的主要是 等,生长因子是 。
⑵ _______ 。
⑶菌丝生长到一定阶段会形成子实体,这是由于细胞进行 和 的结果。子实体上长出的孢子的基因型与菌丝的基因型 。
⑷在培养过程中,发现接种量大的培养瓶中不容易感染杂菌,而接种量小的培养瓶则容易感染杂菌,从种间关系的角度分析其最可能原因是 。从种内关系的角度分析_____________________________.
班级 姓名 座号 得分
物理试卷答卷
22.⑴__________m ⑵__________J, ___________J.
|
|
| 24. |

| 24.(续) |
 23.
23.