试卷类型:A
高考理科综合仿真试题(二)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分为300分,考试时间为150分钟。
第Ⅰ卷(选择题,共144分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。考试结束,将试题卷和答题卡一并交回。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
本卷共24题,每题6分,共144分。在下列各题的四个选项中,只有一个选项是符合题目要求的。
1. “人类基因组计划”是二十世纪末、二十一世纪初最宏伟的基因工程,参与这一计划的有美、英、日、法和中国等五国的科学家。这项计划是绘制人类全部的大约10万个基因的位置等(含全部DNA约30亿个碱基对的排列排序)。试问“人类基因组计划”需要测定人类的染色体条数为
A.22 B.23 C.24 D.46
2. 近年来,我国一些地区多次出现沙尘暴天气。下列与治理沙尘暴有关的一组措施是
①大力植树,营造防护林 ②保护草原,控制载畜量 ③围湖造田 ④退耕还草
A.①②③ B.①③④ C.①②③④ D.①②④
3. 能使大棚作物有机物积累最多的一组措施是①长光照、短黑暗 ②长黑暗、短光照
③恒温25℃ ④白天25℃,夜间15℃ ⑤白天15℃,夜间25℃
A. ①③ B.②③ C.①④ D.①⑤
4. 某植物在合成蛋白质时,消耗了5020kJ的能量,如这些能量全来自有氧呼吸,而有氧呼吸消耗的O2又来自光合作用所释放的氧,则被分解的水的摩尔数为
A. 12 B. 24 C. 48 D.96
5.如图2—1所示,①、②为两种放大倍数不同的物镜,③、④为两种放大倍数不同的目镜,⑤、⑥为观察时物镜与玻片标本间的距离。下列观察到的细胞数目最多的组合是
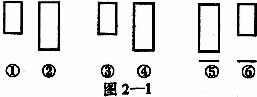
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
6. 下列物质属于易燃易爆物质,不能带上火车、轮船的是①硝酸铵 ②硫酸铵 ③氯化钾 ④氯酸钾 ⑤火棉 ⑥汽油 ⑦电木塑料
A.只有①④⑤⑥ B.除①②③外
C.只有④⑥ D.全部
7. 下列叙述正确的是
A.pH=3的酸溶液稀释100倍后pH=5
B.在相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍
C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH
D.碳酸钠溶液在室温时的pH一定大于60℃时的pH
8. 某煤的样品按其元素组成折算成原子数比,可用C135H96O9NS表示。以下有关论述不正确的是
A.它是一种组成复杂的有机物
B.煤高温燃烧可生成污染大气的硫、氮氧化物
 C.从煤的干馏产物煤焦油中可分离得到多种芳香族化合物
C.从煤的干馏产物煤焦油中可分离得到多种芳香族化合物
D.煤在干馏时有氨生成
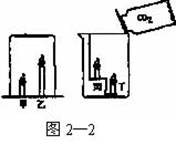
9. 图2—2表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放在燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体。在两项实验中先熄灭的蜡烛分别是
A.甲、丙 B.乙、丙
C.甲、丁 D.乙、丁
![]() 10.在一定条件下,可逆反应X(g)+3Y(g) 2Z(g),达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比为
10.在一定条件下,可逆反应X(g)+3Y(g) 2Z(g),达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比为
A.1∶3 B.3∶1 C.3∶2 D.1∶2
11.Fe和Fe2O3的混合物共15 g,加入稀H2SO4150 mL,在标准状况下放出1.68 L Hz,Fe和Fe2O3均无剩余。为中和过量H2SO4并使FeSO4转化为Fe(OH)2沉淀,消耗3 mol/L NaOH溶液200 mL,则该稀H2SO4溶液的物质的量浓度为
A.2.25 mol/L B.2 mol/L
C.0.3 mol/L D.0.6 mol/L
12. 电子工业常用FeCl3溶液腐蚀印刷电路板。欲从腐蚀后的废液中回收铜并制取纯净的FeCl3溶液,需要用下列试剂中的①蒸馏水 ②Fe粉 ③浓HNO3 ④浓盐酸
⑤烧碱 ⑥浓氨水 ⑦Cl2
A.①②④⑦ B.①③④⑥ C.②④⑥⑦ D.①④⑥⑦
13. 25℃时,某氯化铵溶液的pH为4,下列说法正确的是
A.溶液中c(H+)>c(OH-)且c(H+)·c(OH-)=1×10-14
B.由水电离出来的c(H+)约为1×10-14 mol·L-1
C.溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.此溶液中水的电离度约为1.8×10-4%
14. 甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,根据表中数据判断下列叙述正确的是
A.混合后甲、乙溶液的质量分数均大于5%
B.混合后乙溶液的质量分数大于5%,甲溶液的质量分数小于5%
C.混合后甲溶液的质量分数大于5%,乙溶液的质量分数小于5%
D.混合后甲、乙溶液的质量分数均等于5%
|
质量分数 | 甲的溶液 | 乙的溶液 |
| 1% | 0.95 | 1.02 |
| 5% | 0.92 | 1.04 |
| 10% | 0.90 | 1.10 |
15. 无线电波、红外线、可见光、紫外线、伦琴射线、γ射线合起来,构成了范围广阔的电磁波谱。不同的电磁波产生的机理不同,表现出的特性也不同。在应用电磁波的特性时,下列各项中说法正确的是①化学反应可以用红外线照射的办法,提高化学反应的速率 ②用紫外线照射马铃薯,可以防止马铃薯发芽,利于长期保存 ③检查钢板内部有没有砂眼或裂纹,用X射线比用γ射线好 ④用γ射线处理医院排放的污水,可杀死各种病原体,保护环境免受污染
A.①② B.②③ C.②④ D.①④
16.在匀强电场中做曲线运动的质子,单位时间内速度的改变量总是
A.大小相等,方向相同 B.大小不等,方向不同
 C.大小相等,方向不同 D.大小不等,方向相同
C.大小相等,方向不同 D.大小不等,方向相同
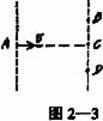
17. 如图2—3,空间的某一区域内存在着相互垂直的匀强电场和匀强磁场,一个带电粒子以某一初速度由A点进入这个区域沿直线运动,从C点离开区域;如果这个区域只有电场,则粒子从B点离开场区;如果这个区域只有磁场,则粒子从D点离开场区;设粒子在上述三种情况下,从A到B点、A到C点和A到D点所用的时间分别是t1、t2和t3,比较t1、t2和t3的大小,则有(粒子重力忽略不计)
A.t1=t2=t3 B.t2<t1<t3 C.t1=t2<t3 D.t1=t3>t2
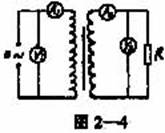 18. 如图2—4所示,一理想变压器的原线圈匝数n1=1000匝,副线圈匝数n2=200匝,交变电源的电动势e=311sin(100πt)V,电阻R=880Ω,电流表和电压表对电路的影响可忽略不计,则下列说法正确的是①V1的示数约为311V ②V2的示数约为44V ③A1的示数约为0.01A ④A2的示数约为0.75A
18. 如图2—4所示,一理想变压器的原线圈匝数n1=1000匝,副线圈匝数n2=200匝,交变电源的电动势e=311sin(100πt)V,电阻R=880Ω,电流表和电压表对电路的影响可忽略不计,则下列说法正确的是①V1的示数约为311V ②V2的示数约为44V ③A1的示数约为0.01A ④A2的示数约为0.75A
A.①② B.②③ C.①④ D.①③
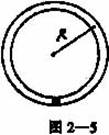 19.如图2—5所示,一内壁粗糙的环形细圆管,位于竖直平面内,环形的半径为R(比细管的直径大得多),在圆管中有一个直径比细管内径略小些的小球(可视为质点),小球的质量为m,设某一时刻小球通过轨道的最低点时对管壁的压力为7 mg。此后小球便作圆周运动,经过半个圆周恰能通过最高点,则此过程中小球克服摩擦力所做的功是
19.如图2—5所示,一内壁粗糙的环形细圆管,位于竖直平面内,环形的半径为R(比细管的直径大得多),在圆管中有一个直径比细管内径略小些的小球(可视为质点),小球的质量为m,设某一时刻小球通过轨道的最低点时对管壁的压力为7 mg。此后小球便作圆周运动,经过半个圆周恰能通过最高点,则此过程中小球克服摩擦力所做的功是
A.![]() mgR B.mgR C.2mgR D.3mgR
mgR B.mgR C.2mgR D.3mgR
20.有一种感光胶片,叫红外线胶片,它对可见光不敏感,只有红外线能使它感光。这种胶片可以用普通相机进行红外摄影,如果物体用普通胶片摄影时成一个等大的像,若用红外线胶片摄影时也要成一个等大的像,那么相机应如何调节
A.物距减小,缩短暗箱长度 B.物距增大,缩短暗箱长度
C.物距减小,增加暗箱长度 D.物距增大,增加暗箱长度
21.氢作为一种清洁能源,正日益受到各国的重视,许多汽车厂商正努力研究用氢作为燃料来取代汽油,生产21世纪的“环保”汽车,假若有质量为M(含驾驶员的质量)的汽车,以氢气为燃料(氢气重力与汽车重力相比,可忽略),其发动机的效率为η,且在2H2(g)+O2(g)
=====2H2O(g)+E的反应条件下,使汽车从某斜坡的底端匀速驶上动摩擦因数为μ、长为L、倾角为θ的斜坡顶端,则汽车做的功和需要燃烧标准状况下(标准状况下1 mol氢气体积为V0)的氢气体积有下列说法①汽车做功为MgL(sinθ+μcosθ) ②汽车做功为ηMgL(sinθ+
μcosθ) ③需燃烧氢气的体积为![]() ④需燃烧氢气的体积为ηMgL(sinθ+μcosθ)·EV0以上说法中正确的是
④需燃烧氢气的体积为ηMgL(sinθ+μcosθ)·EV0以上说法中正确的是
 A.①④ B.①③ C.②③ D.②④
A.①④ B.①③ C.②③ D.②④
22.如图2—6所示,两端封闭的粗细均匀的U形管,两边封有理想气体,U形管处在竖直平面内,且左管置于容器M中,右管置于容器N中,设M的初温为T1,N的初温为T2,此时右管水银面比左管水银面高h。若同时将M、N的温度升高ΔT,则下列说法正确的是
①h可能不变 ②h一定增大 ③右管气体压强一定增大 ④左管气体体积不可能减少
A.①③ B.②③ C.②④ D.①④
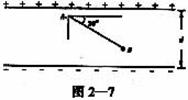 23.图2—7所示的是一个平行板电容器,其电容为C,带电量为Q,上极板带正电。现将一个试探电荷q由两极板间的A点移动到B点,A、B两点间的距离为s,连线AB与极板间的夹角为30°,则电场力对试探电荷q所做的功等于
23.图2—7所示的是一个平行板电容器,其电容为C,带电量为Q,上极板带正电。现将一个试探电荷q由两极板间的A点移动到B点,A、B两点间的距离为s,连线AB与极板间的夹角为30°,则电场力对试探电荷q所做的功等于
A.![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
24.家用微波炉是一种利用微波的电磁能加热食物的新型灶具,主要由磁控管、波导管、微波加热器、炉门、直流电源、冷却系统、控制系统、外壳等组成。接通电源后,220V交流电经变压器,一方面在次级产生3.4V交流电对磁控管加热,同时在次级产生2000V高压电经整流加到磁控管的阴、阳两极之间,使磁控管产生频率为2450MHz的微波。微波输送至金属制成的加热器(炉腔)被来回反射,微波的电磁作用使食物内分子高频地运动而使食物加快受热,并能最大限度地保存食物中的维生素。有下述说法①微波是振荡电路中自由电子运动而产生的 ②微波是原子外层电子受到激发而产生的③微波炉变压器的高压变压比为![]() ④微波输出功率为700W的磁控管每秒内产生的光子数为2.3×1015个。普朗克常量h=6.63×10-34
J·s.
④微波输出功率为700W的磁控管每秒内产生的光子数为2.3×1015个。普朗克常量h=6.63×10-34
J·s.
上述说法正确的是
A.②③ B.①③ C.③④ D.①④
第Ⅱ卷 (非选择题,共156分)
注意事项:
1.第Ⅱ卷用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
以下数据供解题时参考:
H—1 O—16 S—32 Ca—40 Cl—35.5 N—14 C—12
25.(30分)水的污染,一类是自然因素造成的,如某些地区的地下水溶解地层中的矿物,使水体中盐分、微量元素含量偏高,生物腐烂产生有毒物质影响水质;另一类是人为因素造成的,如工业污水、生活污水的排放,农药、化肥的流失等也会影响水质。
(1)(9分)水中N、P元素含量过高,开始可能引起 大量繁殖,不久便大量死亡,最终导致水生动植物的大量死亡,使水质恶化。在这种环境条件下,水中动植物尸体在微生物作用下分解能产生硫化氢、氨等气体,它们主要来自生物体内的哪类有机物?
(2)(6分)这些微生物大多数属于哪一代谢类型?
(3)(15分)含重铬酸根Cr2O72-的酸性工业污水,是水体污染物,应进行处理。处理的方法之一是,在废水中溶入适量食盐,以铁作阳极进行电解,在电解过程中鼓入空气,使之发生一系列反应。在反应中,Cr2O72-在酸性环境中和亚铁离子反应,生成Fe3+和Cr3+;由于溶液的pH值逐渐升高,最终生成Fe3+和Cr3+的氢氧化物沉淀,使废水中含铬量达到排放标准。经沉降过滤,除去沉淀物,完成处理过程。
①说明在废水中溶入适量食盐的作用
②写出电解过程的电极反应式
③写出Cr2O72-在酸性环境中与亚铁离子反应的离子方程式
26.(20分)蛋清的主要成分是蛋白质,在碱性溶液中,蛋白质与CuSO4中的Cu2+反应能产生紫色络合物,这是蛋白质的颜色反应。请根据这一反应特征,利用下列材料,设计一个实验来证明人的唾液淀粉酶是蛋白质。
实验材料:0.1 g/ml的NaOH溶液、0.01 g/ml的CuSO4溶液、水、试管、滴管、脱酯棉球、镊子、小烧杯。
实验步骤:
(1)收集唾液:
(2)
(3)
(4)
27.(12分)已知甲、乙、丙三种类型的病毒,它们的遗传信息的传递方式分别用图2—8表示。请对图仔细分析后回答下列问题:
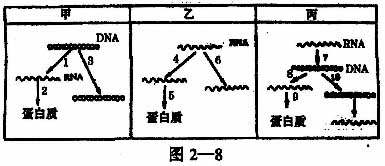
(1)根据我们所学的内容,这三种类型的病毒分别属于:
甲 ;乙 ;丙
(2)图中1、8表示遗传信息的 过程;图中2、5、9表示遗传信息的 过程。
(3)图中哪两个标号所示的过程是对“中心法则”的补充?
28. (24分)某一酒厂以大米为原料,利用酵母菌发酵生产酒精度不低于12度的米酒。其主要工艺流程如下:

 回答下列问题:
回答下列问题:
(1)写出葡萄糖转化为乙醇和二氧化碳气体的化学方程式:
(2)在接种时常加入尿素或其他氮肥,其目的是:
(3)请用曲线表示从接种后到密封前这一阶段酵母菌种群个体数量的变化情况。
(4)如何用化学方法检验蒸馏的酒精中含有水分?
29.(20分)在图2—10甲、乙、丙、丁四个装置中,A、B为未充气气球,C为玻璃导管,D为胶头滴管。实验时把胶头滴管里的溶液(足量)加入锥形瓶中,并轻轻震荡。

(1)(8分)实验过程中可观察到气球的变化:
甲 ;乙 ;
丙 ;丁 。
(2)(8分)用化学方程式表示所发生的化学反应
甲 ,
乙 ,
丙
丁
(3)(6分)反应前后整个装置的质量变化(填“增大”“减小”或“不变”等)
 甲
,乙
,丙
,丁
。
甲
,乙
,丙
,丁
。
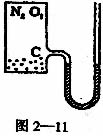
30.(22分)如图2—11,有一绝热密闭容器,容积内有10mol空气(N2体积分数为80%,O2为20%)和一定量碳粉,侧面连接一根体积不计的U形细管(两侧管足够长)。内装有水银,用来测量容器内压强。开始时气体温度为0℃,两端水银柱等高。点燃反应物,使它们充分燃烧。若燃烧前,碳粉质量为10g,燃烧后,右侧管汞柱升高67.5cm。试计算燃烧后
(1)气体的物质的量是多少?
(2)气体的温度是多少?(外界大气压相当于75 cmHg产生的压强)
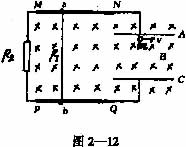 31. (28分)如图2—12所示,MN和PQ是相距40cm的平行金属导轨,一根电阻R1=3Ω的金属棒ab可紧贴平行导轨运动,两块相互平行、相距20cm且水平放置的金属板A和C分别与两平行导轨相连接,图中跨接在MN间的电阻R2=1Ω,导轨和连接线的电阻均可忽略不计,现将整个装置放置在图示的匀强磁场中,当导体棒ab以速率v匀速沿导轨运动时,恰能使一个质量为m、带电量为q的负电微粒也以速率v在两金属板内空间做匀速圆周运动而不触及两板,求:
31. (28分)如图2—12所示,MN和PQ是相距40cm的平行金属导轨,一根电阻R1=3Ω的金属棒ab可紧贴平行导轨运动,两块相互平行、相距20cm且水平放置的金属板A和C分别与两平行导轨相连接,图中跨接在MN间的电阻R2=1Ω,导轨和连接线的电阻均可忽略不计,现将整个装置放置在图示的匀强磁场中,当导体棒ab以速率v匀速沿导轨运动时,恰能使一个质量为m、带电量为q的负电微粒也以速率v在两金属板内空间做匀速圆周运动而不触及两板,求:
(1)(6分)金属棒ab的运动方向。
(2)(12分)金属棒ab匀速运动速度v的取值范围。
(3)(10分)若带电微粒在匀强磁场中从如图2—12所示位置开始运动,当运动位移达到![]() 时的时间。
时的时间。
 |
『答案』
1.C 2.D 3.C 4.C 5.C 6.A 7.B 8.A 9.D 10.D 11.B 12.A 13.B 14.B 15.D 16.A17.C 18.B 19.A 20.D 21.B 22.B 23.D 24.B
25.(1)浮游植物(或水生植物) 蛋白质 (2)厌氧异养型
(3)①增大溶液导电性 ②阳极:Fe-2e-=Fe2+ 阴极:2H++2e-=H2↑
③6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
26.(1)收集唾液:用清水将口漱净,口含一块脱酯棉;片刻后用镊子取出,并将其中的唾液挤入试管或用凉开水嗽口后,略微张开口,舌尖抵在下颌门齿的下方,约3分钟,将下唇搁在另一小烧杯口上,唾液就会沿着下唇流入杯中。
(2)用滴管向试管中滴加2~3滴5%的NaOH溶液,振荡
(3)用滴管向试管中滴加2~3滴3%的CuSO4溶液,振荡
(4)结果观察:振荡后,静置一会儿,观察到出现紫色,说明唾液淀粉酶是蛋白质(每一步骤5分,共20分)
27.(每空2分)(1)甲:DNA病毒;乙:RNA病毒;丙:致癌病毒
(2)转录;翻译
(3)6、7;(或4、7)
酶
![]() 28.(1)C6H12O6 2C2H5OH+2CO2↑(4分);
28.(1)C6H12O6 2C2H5OH+2CO2↑(4分);
(2)提供酵母菌生长所需的氮元素(4分);
(3)如右图(8分)(能画出始终向上趋势的均给分);
 (4)投入无水硫酸铜,无水硫酸铜变成蓝色,或投入电石有气体产生等(其他正确答案均可得分)(8分)
(4)投入无水硫酸铜,无水硫酸铜变成蓝色,或投入电石有气体产生等(其他正确答案均可得分)(8分)
29.(1)(8分)气球B胀大;气球A胀大;气球A逐渐胀大;(其他正确答案均给分)气球B先胀大,片刻后,气球B缩小,气球A胀大。(各2分)
(2)(8分)2NaOH+SO2=====Na2SO3+H2O;
Na2SO3+H2SO4=====Na2SO4+H2O+SO2↑;
酶
![]() C6H12O6+6O2+6H2O 6CO2+12H2O
C6H12O6+6O2+6H2O 6CO2+12H2O
酶
![]() C6H12O6
2C2H5OH+2CO2
C6H12O6
2C2H5OH+2CO2
2NaOH+2H2O+2Al=====2NaAlO2+3H2↑;(每个方程各2分)
(3)(4分)增大;不变;不变;先增大,而后变小。(各1分)
30.解:(1)O2的物质的量约为2mol,则此可判断O2过量(6分)
根据C+O2=====CO2知,燃烧前后,气体总物质的量不变,即仍为10mol(6分)
∴![]() 273=764(K)(10分)
273=764(K)(10分)
∴这时气体温度为764K。
31.解:(1)要使微粒做圆周运动,其受到的电场力与重力平衡,所以电场力方向应向下。即电场方向竖直向下,则Ua>Ub,根据右手定则,ab棒应向右运动。(4分)
(2)电场力与重力平衡
mg=qE ① (2分)
两板间场强
E=![]() ② (2分)
② (2分)
两板间电压
U=![]() ③ (2分)
③ (2分)
棒产生的感应电动势
 ε=Blv ④ (2分)
ε=Blv ④ (2分)
微粒由洛仑兹力提供向心力做圆周运动
qvB=m![]() ⑤ (3分)
⑤ (3分)
微粒运动时不触及两板,∴r<![]() d ⑥ (3分)
d ⑥ (3分)
联立①②③④⑤⑥式,代入数据解得v<1.4 m/s (2分)
(3)由⑤式得r=![]() ,如图所示,在一个周期内,当位移s=
,如图所示,在一个周期内,当位移s=![]() 时,t=
时,t=![]() (2分)或
(2分)或![]() T(2分),式中T=
T(2分),式中T=![]() .
.
考虑到周期性,则经过的时间:
t=![]() (n=0,1,2,3…)(4分)
(n=0,1,2,3…)(4分)
 密度/g·cm-3 溶液
密度/g·cm-3 溶液