湖南省部分重点中学联考理科综合
相对原子质量 C 12 H1l O16 N 14 S 32 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(选择题共120分)
本卷共24题,每题5分,共120分,每题有四个答案可供选择,其中只有一个答案符合题目要求。
1.有中国参加的,包括美、英、法、日和德等国科学家联合实施的“人类基因组计划”,是当今一项最伟大的科学工程,主要任务有基因组整体序列的测序工作。其序列是指
A.DNA的碱基排列顺序 B.信使RNA的碱基排列顺序
C.转运RNA的碱基排列顺序 D.蛋白质的氨基酸排列顺序
2.这是植物中氧释放和吸收速度有关的资料,植物受12小时黑暗,随后进行12小时光照,温度不变,结果如下图。下面是在24小时的实验时间内通过植物呼吸消耗的氧的总体积,哪一个是最正确的估计?
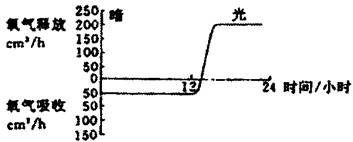
A,600cm3 II.1000cm3
C.1200cm3 D.1800cm3
3.关于植物生长素的叙述中,不真实的一项是
A.在植物中生长素是相当少的
B.生长索移动主要从顶端转向基部
C.生长素的运输不需要能量
D.燕麦胚芽鞘顶端的生长素从向光侧横向运输到背光侧
4.如右图所示:水稻的光合作用强度,呼吸强度与叶面积指数(单位面积内叶面积和)的关系。下列叙述中,哪项不正确?

A.呼吸量与叶面积指数成正比
B.阴影部分为光合作用积累的物质量
C.叶面积指数越大,光合作用越强
D.叶面积指数为4时,光合产物最多
5.在群落发展过程中,群落中一些种群兴起了,一些种群衰落以至消失了。群落的这种变化随着时间的推移而发生的有规律的变化称为演替。右下图为从温带原始裸地开始的群落演替过程中两种量值的变化曲线。它们表示的是
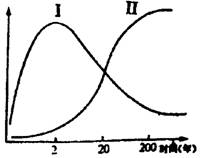
A.Ⅰ曲线表示草本植物和种类数量,Ⅱ曲线表示整个植被的生物量(重量)
B.Ⅰ表示整个种群的生物量,Ⅱ表示草本植物的各类数量
C.Ⅰ表示土壤中腐殖质总量,Ⅱ表示植被中的种类数量
D.Ⅰ表示食肉类的种类数量,Ⅱ表示食肉类的生物总量
6.“可燃冰”是水与天然气相互作用形成的晶体,主要存在于冻土层和海底大陆架中,晶体中平均每46个水分子构建成8个笼,每个笼可容纳五个CH4分子或者一个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O填充。由此可判断下列说法中正确的是
A.“可燃冰”的平均组成为CH4·6H2O B.“可燃冰”在常温、常压下是一种稳定物质
C.高温、低压有助于可燃冰的形成 D.“可燃冰”的平均组成为CH4·8H2O
7.下列分离方法正确的是
①用盐析法可以提纯蛋白质 ②用渗析法可以除去淀粉中的NaCl ③用加热法可以除去I2中的NH4Cl ④用重结晶法可以分离KNO3和NaCl ⑤用分液法可以除去苯中的甲苯
A.①②③④ B.①②④⑤ C.②③④⑤ D.①②④
8.在体积均为1L,pH均等于2的盐酸与醋酸溶液中,分别投入0.28g铁,则图中哪组曲线比较符合反应事实

9.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝土矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀 D.Al(OH)3是难溶物
10.1999年诺贝尔化学奖授予具有埃及和美国双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时分子中原子的运动”成为可能,在他的研究中证实了光可诱发如右所示变化:
这一事实可用于解释人眼的夜视功能,有关X、Y的叙述不正确的是
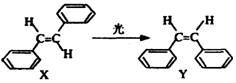
A.X和Y都可发生加聚反应
B.X和Y是 的同系物
的同系物
C.X和Y中所有原子可以处于同一平面
D.X的同分异构体(有两个苯环结构)只有四种
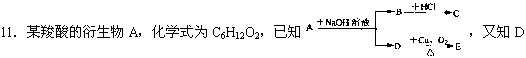 不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A结构可能有
不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A结构可能有
A.2种 B.3种 C.4种 D.6种
12.下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是
H++OH-,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4),溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
13.已知某饱和溶液的:
①溶液的质量 ②溶剂的质量 ③溶液的体积
④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度
从以上条件的组合上,不能用来计算该饱和溶液的物质的量浓度的是
A.①④⑥ B.④⑤⑥ C.①②③④ D.①③④⑤
14.测定阿伏加德罗常数的实验方法中有一种电解法:以石墨为电极电解CuCl2溶液,当电流为IA,通过时间为t min,阴极增重mg(设一个电子的电量为qC,铜的相对原子质量为M),则阿伏加德罗常数可表示为
![]()
![]()
![]()
![]()
15.在容积固定的4L密闭容器中,进行可逆反应:X(g)+2Y(g)![]() 2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正),v(逆)与时间t的关系如右图所示。则图中阴影部分面积表示
2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正),v(逆)与时间t的关系如右图所示。则图中阴影部分面积表示
A.X的浓度的减少 B.Y物质的量的减少
C.Z浓度的增加 D.X物质的量的减少
16.一个灯泡,当其两端的电压为6V时,测得通过他的电流为0.5A,当电压降为3V时,流过灯丝的电流为0.4A,那么当灯泡两端的电压为5V时,流过灯丝的电流为:

A.I=0.42A B.I=0.67A
C.0.42A<I<0.5A D.I<0.42A
17.一个人用于竖直提着10千克的物体,以速度2m/s匀速爬上一个坡度为30°的斜面,g取10m/s2,以下说法正确的是:
A.人对物体做的功为零 B.人对物体做功的功率为200W
C.人对物体做功的功率为173W D,物体的重力势能每秒钟增加100J
18.一个托盘在竖直方向上做简谐振动,在托盘中放一硬币,以下说法正确的是:
A.只要托盘做简谐振动的振幅大,就能听到硬币与托盘的碰撞声
B.只要托盘做简谐振动的频率大,就能听到硬币与托盘的碰撞声
C.只要托盘做简谐振动的最大加速度大于g,就能听到托盘与硬币的磁撞声
D.只要托盘做简谐振动的最大速度大,就能听到托盘与硬币的碰撞声
19.我们用比较低档的望远镜看远处的物体时,会看到物体边缘有彩色的轮廓,这是因为:
A.光的色散现象 B.光的干涉现象
C.光的衍射现象 D.光的粒子性引起的现象
20.有两个电压表,将每个电压表的正负接线柱用一导线直接相连,然后轻轻的摇动电压表,使指针发生摆动,发现甲表指针摆动几下就停下来了,而乙表指针摆动很长时间才慢慢停止摆动,导线是好的并且连接处保证接触良好,那么:
A.甲表一定是坏表 B.乙表一定是坏表
C.乙表可能是坏表 D.不能确定谁一定是坏表
21.二极管具有单向导电性,当电流从“+”流入时二极管导通(认为无电阻),而从“-”流入时二极管截止(电阻无穷大)。如右图所示,设电源电压为u=311sin(100πt)V,那么图中电压表(理想电表)的读数为:
A,220V B.110V C.155.5V D.311V
22.以下几项命题符合事实的是:
①一个平行板电容器网极板间(其间是空气)的距离为4mm,电容为10pF,其两端的电压为2200V(空气的击穿场强为3×106V/m),求该电容器的带电量。
②设一个人造地球卫星绕地球做圆周运动的周期为60mim,求该卫星的轨道半径。
③某人抬头看到一颗印有USA字样的导弹从80Km远处的空中飞来,其飞行速度为500m/s……
④在右图所示电路中,我们发现断开S的时候,灯泡会猛然亮一下才渐渐熄灭,如果增大线圈的自感系数,灯泡在S断开的瞬间就越亮,……
A.只有①正确 B.①②正确
C.①③④正确 D.③④正确
23.一定质量的理想气体从M沿直线变化到N(如图所示),以下说法正确的是:
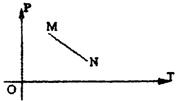
①气体的内能增大 ②气体的密度减小
③气体对外界做正功 ④气体的![]() 的值发生变化
的值发生变化
⑤气体分子的平均动能增大
A.①④正确 B.①②③⑤正确
C.①②③④正确 D.③④⑤正确
24.如图所示,在足够宽广的斜面上(有摩擦)放有一个质量为m,带电量为q的小垫圈,磁感强度为B的匀强磁场垂直于斜面,垫圈无初速度下滑,以下说法正确的是:( )

A.小垫圈将一直做曲线运动
B.小垫圈将一直做直线运动
C.小垫圈将做圆运动
D.小垫圈最终将做匀速直线运动
第Ⅱ卷(非选择题 共180分)
25.(20分)(1)下图表示某动物精原细胞进行细胞分裂时染色体的变化情况(图中的字母之间表示不同分裂时期)。请据图分析回答:
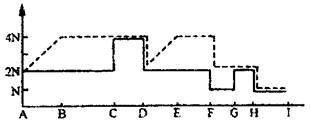
①该细胞分裂了几次?__________________________。
②图中什么分裂时期的染色体和DNA分子数与精原细胞相同?_______________________。
③图中C~D时期的染色体变化特点是:__________________________。
④若用化学药剂抑制该细胞的A~B时期,会出现的现象是__________________________。
(2)在观察根对矿质元素离子的交换吸附现象的实验中,剪取数条新鲜的洋葱根,将它们浸泡到亚甲基蓝的质量浓度为0.1mg/ml的溶液中,1~2min以后,根染成了蓝色。因亚甲基蓝的阳离子呈蓝色和氯离子无色,根细胞表面的H+就会与亚甲基蓝的阳离子发生交换吸附,所以根被染成蓝色。
根据你所学习的知识,请设计一个实验证明实验中,根细胞表面的HCO![]() 与亚甲基蓝溶液中的Cl-发生了交换吸附。
与亚甲基蓝溶液中的Cl-发生了交换吸附。
①方法步骤:___________________________________________。②结果分析:___________________________________________。
26.(22分)阅读下列材料:
材料一 2001年9月11日,美国纽约的标志性建筑曼哈顿区世贸中心塔楼被炸毁,带来了一场意想不到的环境灾难:石棉污染。
材料二 美国自“9·11”恐怖事件后,在华盛顿、新泽西、佛罗里达等地相继发生“炭疽邮件”事件,使有些人感染了炭疽热孢子而患炭疽热病。
材料三 炭疽热由炭疽杆菌造成,这种细菌易导致动物发病,尤其是食草反刍动物(如牛、羊等)。当动物死亡后,炭疽热杆菌形成孢子。一旦炭疽热杆菌孢子进入健康的生物体,它们会以惊人的速度呈几何倍数激增。
材料四 大多数种类的炭疽热都对青霉素非常敏感。医生建议:在预防和治疗炭疽热病时应使用青霉素,并配合环丙沙星、强力青霉素等抗生素。
材料五 据反恐专家说,对付炭疽孢子用蒸汽熨斗加一层湿布,进行熨烫,其消毒效果比用微波炉消毒好。
回答下列问题:
(1)石棉的化学式为CaMg3Si4O12,则用氧化物形式表示的化学式是___________________________________________。
(2)炭疽杆菌与酵母菌相比,在结构上的特点是_________________________________
(3)从同化作用的方式看,炭疽杆菌的代谢类型是________________________________。
(4)环丙沙星的结构简式如右图所示:
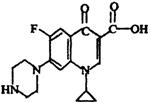
①该物质的分子式为________________________________________________________。
②在通常条件下1mol该物质最多能与_________________molH2加成。
③用一个氯原子代替该物质中碳原子上的一个氢原子,其产物有_________________种。
(5)青霉素试验针用它的稀溶液(200国际单位青霉素/mL)。现有1小瓶20万国际单位青霉素,1.0mL注射器(分刻度为0.1mL),注射用水和几个干净小瓶。现吸取1.0mL注射用水注入第1瓶内溶解青霉素,又吸取0.1mL溶液在第2小瓶中用水稀释成1.0mL,再从第2小瓶中吸取0.1mL在第3小瓶中稀释成1.0mL,依次类推……,则在第__________瓶中青霉素浓度为200国际单位/mL。
A.6 B.5 C.4 D.3
(6)若将一只容积为1000mL、功率为1000W的蒸汽熨斗接到220V的电源上,使20℃的水都转变为蒸汽,至少需要多长时间?(水的比热C=4.2×103J/Ke·K,水在100℃时的汽化热L=2.26×106J/Kg)
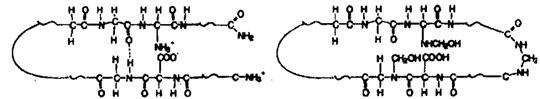
27.(20分)某中学同学在一本英文杂志上发现2张描述结构变化的简图A和图B如下(图中—~—是长链的省略符号):
请回答下列问题:
(1)图A表示的是生命体内最重要的一类物质是_________________;合成此类物质的细胞结构是________________________;合成此类物质的化学反应方式叫______________________。
(2)图B是图A的物质与_________________物质发生反应后的结果(填物质的名称)。
此小分子物质的水溶液在生物实验室中通常用于_________________、消毒等。此小分子物质在低温条件下长期放置会产生白色沉淀(一种高分子物质),请写出此反应的化学方程式_________________。
(3)近年来,一些不法奸商在生产米粉、腐竹、馒头等食品时,添加能产生该小分子物质的工业漂白剂(吊白块)等,以增加食品的白度和韧性,但人食用后会损坏肝、肾,出现视力减退和粘膜坏死等症状,还有强致癌作用。添加了“吊白块”的食品有韧性的原因是__________________________________________________。
28.(22分)金属M可以在不同条件下发生下列五个反应:
M+A→I;M+B→H;M+C→H+F;M+D→H+A;M+E→I+G,其中:
①A、B、C、D在通常状况下都是气体,并知C是CO2;
②上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C,G+A→E;
③I是一种离子化合物,它可以水解产生一种白色沉淀和气体E。该白色沉淀加热可分解为H和H2O。而E则是分子晶体,其分子中共有10个电子。
回答下列问题:
(1)在实验室中收集气体E的方法是__________________________________________。
(2)写出I和水反应的化学方程式____________________________________________。
(3)B的化学式是____________________________________________________。
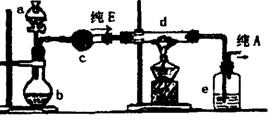
(4)在实验室中,如果要获得干燥纯净的气体A,实验装置设计如右图所示:

在上列装置b中原装的是一种固体物质,当s中的溶液滴入b内反应一段时间后,所得产物经装置c即为纯净气体E;在装置d中原装的是氧化铜,当E通入d时,氧化铜逐渐变为铜,最后从装置e中出来的气体是纯净的A气体。
①a中溶液和b中固体反应的化学方程式是_____________________________________。
②c装置盛放的试剂是______________________________________________________。
③纯净E通过d时反应的化学方程式是________________________________________。
④装置e盛放的试剂是______________________________________________________。
⑤收集干燥气体A的方法是(选a、b或c)____________________________。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
29.(30分)(1)由国防科大领衔研究建造的我国第一条中低速磁悬浮列车试验线,在长沙建成通车并通过试验收评审。它与普通轮轨列车相比,具有低噪音、低能耗、无污染、安全舒适和高速高效的特点,有着“零高度飞行器”的美誉。某实验人员在车厢中无意中用录像机摄到一段水滴从车厢顶落下时的情形,放出来时其轨迹图如上图所示,所有格子均为正方形,那么此段时间内列车做匀加速直线运动,其加速度为____________________________________________________。由此图景,能否求出列车在此段时间内的平均速度?如能,请求出来,不能请简单说明理由。(g取10m/s2)______________________________________。
(2)如右下图所示,是用有机玻璃做成的容器,上部是开口的,中间用很薄的(厚度可不计)有机玻璃做成封闭的隔板,下部是密封的但在旁边开有两个小孔。然后取适量的稀食盐溶液,在其中滴入适量的硝酸银溶液,制成_______________________胶体,置于容器的上部。再用两根玻璃棒分别粘一些浓氨水和浓盐酸,将玻璃棒分别从容器下部两小孔插入到容器中,其挥发出的氨气和氯化氢气体,在容器中生成____________________烟。待浓度合适时,抽出玻璃棒,用不干胶将两个小孔封闭这样在容器中的上下两层制成了液相与气相两层胶体。然后用一支玩具激光笔作光源,从上部胶体溶液中向下照射,光线照在两种胶体的交界面上时,会清楚地看到入射光线、反射光线和折射光线(这是本实验的优点)。

①改变入射光的入射角,反射光线和折射光线的方向将随之一起发生改变。随着入射角的增大,可以看到折射光的强度_________________,而反射光线的强度_________________________________________________。该实验__________________(可以,不可以)看到全反射现象。
②假设下部气相胶体的折射近似为1,能否测出上层液体的折射率(玻璃上有角度刻度)?如能,简单说明操作步骤,如不能,请说明理由。______________________________________。
(3)研究电磁感应的实验时,首先要查明__________________的关系。其实验仪器如图所示,请连接好实物图。某同学在连好线路后,合上开关时发现电流表指针右偏,试填写下表:
30.(15分)2002年3月25日晚10时15分,我国在酒泉卫星发射中心成功发射了“神舟”三号宇宙飞船,为不久的将来把中国航天员送上太空打下了坚实的基础。载人航天是一件十分复杂的工程,因为太空是一个高真空、超低温、强辐射的场所,这种环境对人体来说是致命的,所以“神舟”三号飞船还没有真正的宇航员。试根据以上材料以及下面相关的假设回答以下问题:

| 实验操作 | 指针偏向 |
| 在原线圈中插入软铁棒 | |
| 拔出原线圈时 | |
| 断开开关时 | |
| 移动滑动触头减小电流 |
①在太空中,有许多射线和高能粒子,如果直接射在人体上会使人体产生病变,其原因是_________________________________________,因此宇航员要穿上特制的衣服。
②假设飞船在离地面h的高度环绕地球做圆周运动(不考虑地球自转),试求飞船的环绕速度(已知地球表面的重力加速度为g,地球的半径为R)。
③若飞船垂直发射(不考虑地球自转),并认为飞船的速度是均匀增加的,为了使飞船达到轨道高度h后,只需要用转向火箭转向调整方向(不改变速度大小),即可进入轨道飞行,求飞船上升的加速度。
④飞船进入距地表nR的轨道(R为地球半径)绕地球做圆运动时,质量为60kg的宇航员他的视重为多少?实际所受重力为多少?(g取10m/s2)
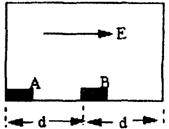
31.(15分)如右图所示,两个长方体金属块(长度相对d而言可不计)摆放在光滑的绝缘框内,A开始带有Q的正电荷,B不带电,质量均为m,空间有水平向右的匀强电场E,且QE=mg,所有碰撞均无机械能的损失,当A与B碰撞时,由于电场力,恰好使所有的正电荷全部转移到B上,试求:(1)AB碰后的再一次相碰发生在何处?
(2)第三次碰撞点距右边壁多远?
32.(34分)在地球上,90%的臭氧分布在距地面25km的平流层,在吸收紫外线方面起着重要的作用,平流层中一旦缺少臭氧,对生物有害的紫外线就会毫无遮挡地照射到地面上,过多的紫外线照射会提高皮肤癌和白内障的发病率,也会影响人类的免疫系统,对地球的生物化学循环和生物的生长、发育、繁殖,分布都会造成严重的危害。
(1)设地球半径为R=6400km,在离地面20—30km的平均温度为9℃,压强为5500Pa,地球表面温度为180℃,压强为1.0×105Pa,请求出这部分气体全部集中在地球表面时的厚度h。而这部分气体中是臭氧含量最多的(占整个臭氧量的90%以上),但将大气层中的臭氧全部集中到地球表面,折合成标准状况下其厚度大约只有0.3cm左右,由此估算整个大气层中臭氧的质量。[注:当x![]() 1时,(1+x)n≈1+nx]
1时,(1+x)n≈1+nx]
(2)氢原子处于基态时能量为-13.6eV,它从n=2能级向基态跃迁时,发出的紫外线波长为多少?
(3)由于臭氧在紫外线波长200—300mm的谱段有强吸收带,在300—340mm的谱段有弱吸收带,在440—740mm可见光区有吸收带,所以臭氧层可以大量吸收紫外线和可见光。
①试说明紫外线产生的微观机理。__________________________________________
②用上述紫外线照射银板(极限频率为1.15×1015Hz),哪个谱段的光线可能使银板产生光电效应?
(4)一般地把来自太阳的紫外线按波长分为三个区,315—400nm之间的称为UV—A区,该区的紫外线是地表生物所必须的,他可以促进人体的固醇类转化为维生素D;波长为200—280nm之间的称为UV—C区,这部分紫外线不会达到地表而造成不良影响;波长为280—315nm之间的称为UV—B区,这部分紫外线辐射到地表是对人类和生态系统造成最大危害的部分。
在正常情况下,臭氧层可将B区的紫外线绝大部分吸收,而有用的A区确可以达到地表,与我们生命要求正好相符。这是一种巧合吗?从生物学的观点解释。
_______________________________________________________________________________
(5)①高空中的氧气受阳光中紫外线照射,通过下面的反应形成臭氧:
a.O2![]() 2O b.O2+O→O3写出以上a、b反应的总方程式。
2O b.O2+O→O3写出以上a、b反应的总方程式。
_______________________________________________________________________________
②人类大量使用“消耗臭氧层物质”(简称ODS),是使臭氧层被破坏的主要原因,其中CFC(氟利昂)的使用是破坏臭氧层的祸首,氟利昂在阳光下可分解产生氯原子,其破坏臭氧的反应式如下:a.O2![]() 2O b.O3+Cl→O2+ClO c.ClO十O→O2+Cl
2O b.O3+Cl→O2+ClO c.ClO十O→O2+Cl
试写出b、c的总反应方程式。
______________________________________________________________________________。
(6)臭氧是一种具有鱼腥味的胆蓝色气体,能使湿润的碘化钾淀粉试纸变蓝,则反应的化学方程式为____________________________________________,反应中还原产物是____________________________________________。
湖南省部分重点中学联考
答案
1.A 2.D 3.C 4.C 5.A 6.D 7.D 8.B 9.A 10.D 11.A 12.B 13.A 14.B 15.C 16.C 17.D 18.C 19.A 20.B 21.C 22.AB 23.D
25.(20分)(1)(3分/小题)①三次 ②G—H ③染色体的着丝点分裂为二,染色体数目加倍 ④细胞停止分裂(该细胞停留在分裂间期)
(2)①方法步骤(2分/小题):(Ⅰ)将染成蓝色的根用蒸馏水洗去浮色备用
(Ⅱ)取两支试管A、B,分别加入等量的蒸馏水和AgNO3溶液 (Ⅲ)A管中放入蓝色备用的根,B管作对照。
②结果分析(2分):A管中产生白色的沉淀。因为A管中的NO![]() 与根细胞表面的Cl-交换,交换下来的Cl-可与AgNO3溶液中的Ag+形成门色的沉淀物。
与根细胞表面的Cl-交换,交换下来的Cl-可与AgNO3溶液中的Ag+形成门色的沉淀物。
26.(22分)(1)CaO·3MgO·4SiO2 (2分)
(2)没有成形细胞核或没有核膜 (2分) (3)异养型 (2分)
(4)①C17H18O3N3F (2分) ②5(2分) ③7 (2分)
(5)C (5分) (提示:由题意及数归纳法可知第一瓶20万单位/mL;第二瓶2万单位/mL……第n瓶200000×0.1n-1,所以200=200000×0.1n-1,则n=4,故选项为C)
(6)根据公式Q=cm△t+Lm (1分)
Q=4.2×103×1000×10-3×(100-20)J十2.26×106×1000×10-3J=2.596×106J (1分)
t=Q/P=(2.596×106)/1000S=2596S=0.72h (2分)
即至少需要0.72h。 (1分)
27.(22分)(1)蛋白质(或多肽)(2分) 核糖体(3分) 缩合(3分)
(2)甲醛(或HCHO)(3分) 制作动物标本(防腐)(3分)
![]()
(3)甲醛使链状高分子化合物形成环状结构,如图B所示,故韧性增强。(4分)
28.(22分)
(1)向下排空气法(2分) (2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑(4分)
(3)O2 (2分) (4)①NaOH+NH4Cl=NaCl+NH3↑+H2O (4分) ②生石灰或碱石灰 (2分)
③2NH3+3CuO![]() 3Cu+N2↑+3H2O(4分) ④浓硫酸 (2分) ⑤c(2分)
3Cu+N2↑+3H2O(4分) ④浓硫酸 (2分) ⑤c(2分)
29.(共30分)
(1)(共4分)5m/s2 (2分),不能,因为不知道列车的初速度。(2分)
(2)(共14分)无色透明的氯化银 (2分),白烟(或氯化铵)(2分)。
①(6分,每空2分)减弱,增强,可以。
②(4分)由容器壁上的刻度,读出入射角i和折射角r,然后利用公式n=![]() 则可求出。
则可求出。
(3)(共12分)电流表指针偏转方向与电流的流向。(2分)
连接图如下图所示(6分,只要错一根线,就给零分,如果A、B上的线对换而无其它错误,给2分)。右、左、左、左(每空1分。)

30.(共15分)
①基因突变(3分)
②由![]() 和GM=gR2可得:v=R
和GM=gR2可得:v=R![]() (4分)
(4分)
③由2ah=v2可得:a=![]() (4分)
(4分)
④由于处于完全失重状态,所以视重为零(2分),但他的真实重力不为零,应为宇航员在轨道处受到的万有引力。
![]() (2分)
(2分)
31.(共15分)
A以加速度g冲向B,与B发生碰撞,同时电荷转移到B上,A静止而B以初速度![]() ,加速度g冲向右壁,并反弹,回到中点处与A发生第二次碰撞。
,加速度g冲向右壁,并反弹,回到中点处与A发生第二次碰撞。
(5分,没有必要的说明与计算,只有结论不给分)发生第二次碰撞,A获得向左的速度![]() ,而B的速度变为零,然后A做匀速运动,B做初速度为零,加速度为g的匀加速运动。由于A的平均速度大于B的平均速度,因此B必与右壁碰撞后在返回的途中在中点的右边二者发生第三次碰撞。设碰撞点距右壁为X,由运动特点可知,当A反返回中点时,B刚好与右壁碰撞。从此时开始考虑,经t时间二者相碰,得出方程:(3分)
,而B的速度变为零,然后A做匀速运动,B做初速度为零,加速度为g的匀加速运动。由于A的平均速度大于B的平均速度,因此B必与右壁碰撞后在返回的途中在中点的右边二者发生第三次碰撞。设碰撞点距右壁为X,由运动特点可知,当A反返回中点时,B刚好与右壁碰撞。从此时开始考虑,经t时间二者相碰,得出方程:(3分)
![]() gt2=d (3分)解得:t=(2
gt2=d (3分)解得:t=(2![]() -
-![]() ) (2分)
) (2分)
所以:x=(2![]() -3)d (2分)
-3)d (2分)
32.(共34分)
(1)(共8分)当气体处于20至30km的空中时,其对应的体积为:
V1=![]() π[(R+H2)3·(R+H1)3]= 4πR2(H2·H1)
π[(R+H2)3·(R+H1)3]= 4πR2(H2·H1)
当位于地表时,其对应的体积为:v2=4πR2h (1分)
然后根据理想气体的状态方程:![]() (2分)
(2分)
可以求得:h=570m (1分) 纯臭氧的体积为V=4πR2h=1.54×1012m3
(1分)
其对应的摩尔数为:n=6.875×1013mol,所以其质量为:m=0.048×n=3.3×1012kg (2分)
(2)λ=![]() =1.2×10-7m(共3分)
=1.2×10-7m(共3分)
(3)(共6分)①原子外层电子受激发后产生的。(2分)
②200---300nm段(4分,无必要的计算不给分)
(4)(2分)适者生存
(5)(共8分) ①3O2 ![]() 2O3, (4分)②O3+O
2O3, (4分)②O3+O![]() 2O2 (4分)
2O2 (4分)
(6)(共7分)O3+2KI+H2O=2KOH+I2+O2 (4分),KOH(3分)