普通高等学校招生全国统一考试化学(上海卷)
第Ⅰ卷(共66分)
一、选择题(本题共10分),每小题2分,只有一个正确选项。
1.下列产品的使用不会对环境造成污染的是 ( )
A.含磷洗衣粉 B.酒精 C.氟里昂 D.含汞电池
2.下列物质中属于离子化合物的是 ( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
3.据报道,月球上有大量3He存在,以下关于3He的说法正确的是 ( )
A.是4He的同分异构体 B.比4He多一个中子
C.是4He的同位素 D.比4He少一个质子
4.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
5.氢氧化铁胶体稳定存在的主要原因是 ( )
A.胶粒直径小于1nm B.胶粒作布郎运动
C.胶粒带正电荷 D.胶粒不能通过半透膜
二、选择题(本题共36分),每小题3分,只有一个正确选项。
6.下列物质中不会因见光而分解的是 ( )
A.NaHCO3 B.HNO3 C.AgI D.HClO
7.实验室制取下列气体,其反应放热的是 ( )
A.由无水醋酸钠制CH4 B.由乙醇制C2H4
C.由电石制C2H2 D.由氯酸钾制O2
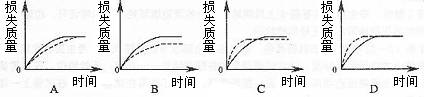
8.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A)B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
9.下列实验操作中,错误的是 ( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B.铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
10.有关晶体的下列说法中正确的是 ( )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
11.将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32—)
B.能使酸性高锰酸钾溶液褪色
C.c(Na+)等于c(CO32—)与c(HCO3—)之和
D.c(HCO3—)略小于c(CO32—)
12.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C—C≡C-C≡C-C≡C-C≡N。对该物质判断正确的是 ( )
A.晶体的硬度与金刚石相当 B.能使酸性高锰酸钾溶液褪色
C.不能发生加成反应 D.可由乙炔和含氮化合物加聚制得
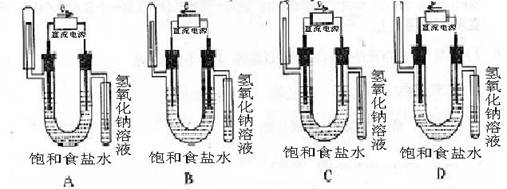
13.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
14.下列离子方程式中正确的是 ( )
A.硫化亚铁放入盐酸中 S2- + 2 H+ → H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S → CuS↓ + 2 H+
C.氯化铝溶液中加入过量氯水 Al3+ + 4NH3•H2O → AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- → CO32- + H2O
15.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是 ( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
16.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
17.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为 ( )
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
三、选择题(共20分)每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是 ( )
A.二氧化碳、二氧化硫、一氧化碳(品红溶液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
19.设NA为阿佛加德罗常数,下列叙述中正确的是 ( )
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
20.下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
21.常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是 ( )
A.pH =12 的Ba(OH)2 B.pH =12的氨水
C.0.005mol/L NaOH D.0.05mol/LBaCl2
22.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有
A.两个羟基 B.一个醛基 C.两个醛基 D.一个羧基
第Ⅱ卷(共84分)
四、(本题共24分)
23.某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
 24.在一定条件下,二氧化碳和氧气发生如下反应:
24.在一定条件下,二氧化碳和氧气发生如下反应:
![]() 2SO2(g)+ O2
(g) 2SO3(g)
+ Q (Q>0)
2SO2(g)+ O2
(g) 2SO3(g)
+ Q (Q>0)
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,
二氧化碳转化率 ,化学反应速度
(以上均填增大、减小或不变)
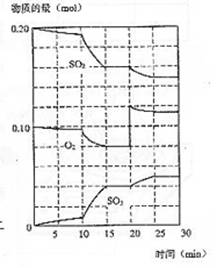
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混
合,反应过程中SO2、O2、SO3物质的量变化如图,
反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的
原因是 (用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
25.右表是元素周期表的一部分。

(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
五、(本题共24分)
26.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量
190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天
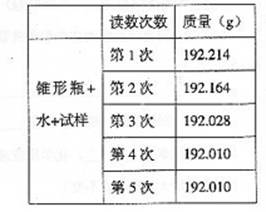
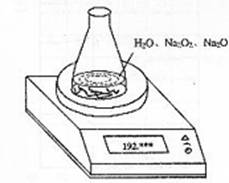 平的数据如表:
平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
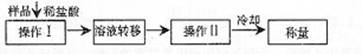
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变)。
 27.航天飞行器座舱内空气更新过程如图所示:
27.航天飞行器座舱内空气更新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学
方程式
(2)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2
和H2O,宇航员每天消耗28mol O2,呼出
23 mol CO2,则宇航员每天呼出的气体中含H2O mol。
(3)以下是另一种将CO2转化为O2的实验设想

其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:

①上图中,装置a由 、 、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是 (填入编号)
c.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
六、(本题共20分)
28.人们对苯的认识有一个不断深化的过程。
(1)1834年德国科学家米希尔里希,通过蒸馏安息香酸( ![]() )和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
(2)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且
无支链链烃的结构简式 。
苯不能使溴水褪色,性质类似烷烃,任写一个苯发生取代反应的化学方程式
(3)烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯(![]() )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
 (4)1866年凯库勒(右图)提出了苯的单、双键交替
(4)1866年凯库勒(右图)提出了苯的单、双键交替
的正六边形平面结构,解释了苯的部分性质,但
还有一些问题尚未解决,它不能解释下列
事实(填入编号)
a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
(5)现代化学认为苯分子碳碳之间的键是 。
 29.从石油裂解中得到的1,3—丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
29.从石油裂解中得到的1,3—丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
(1)写出D的结构简式
(2)写出B的结构简式
(3)写出第②步反应的化学方程式
(4)写出富马酸的一种相邻同系物的结构简式
(5)写出第⑨步反应的化学方程式
(6)以上反应中属于消去反应的是 (填入编号)。
七、(本题共16分)
30.氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
31.黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
![]() (2)已知
(2)已知
产物Cu2S在1200℃高温下班继续反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2
2 Cu2O + Cu2S → 6Cu + SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜
普通高等学校招生全国统一考试
化学参考答案(上海卷)
一、1.B 2. 3.C 4.C 5.C
二、6.A 7.C 8.C 9.D 10.B 11.A 12.B 13.D 14.B 15.C 16.C 17.A
三、18.A 19.A、D 20.A、B 21. C、D 2.D
|
四、23.(1)KMnO4 (2)① 8 ②
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
24.(1)![]() (2)增大 增大 减小 (3)15-20 min和25-30 min
(2)增大 增大 减小 (3)15-20 min和25-30 min
(4)增加了O2的量 a b
|
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O Li
五、26.(1)2Na2O2+2H2O → 4NaOH+O2↑
(2)试样质量 锥形瓶加水的质量 第4(或5)次读数(或用具体数值表示)
锥形瓶内质量已达恒重
(3)①蒸发 ②NaCl的质量 ③烧杯 玻璃棒 ④偏大
|
(3)①分液漏斗 烧瓶
②盐酸 ③防止水解
④e g ⑤
六、(本题共20分)
|
|
(2)
|
(或其它合理答案)
(3)稳定 (4)a d (5)介于单键和双键之间的特殊的键(或其它合理答案)

![]()
![]() 29.(1)[ CH2—CCl=CH—CH2 ]n (2)HOCH2CHClCH2CH2OH
29.(1)[ CH2—CCl=CH—CH2 ]n (2)HOCH2CHClCH2CH2OH
(3)BrCH2CH=CHCH2Br+2H2O HOCH2CH=CHCH2OH+2HBr
 (4)HOOCCH=CHCH2COOH
(或其它合理答案)
(4)HOOCCH=CHCH2COOH
(或其它合理答案)
(5)HOOCCH=CHCOOH+2CH3OH CH3OOCCH=CHCOOCH3+2H2O
(6)④ ⑦
七、30.(1)0.01mol (2)样品总量为(1)的1.5倍
H2O的物质的量为 ![]()
 (3)
(3)![]()
31.(1)82.8% (2)①CuFeS2 Cu+FeO+2SO2
![]()
![]() ② O2不是量 Cu2S+O2 2Cu+SO2
② O2不是量 Cu2S+O2 2Cu+SO2
n(Cu)=6-2(15-14.25)= 4.5 (mol)
③O2过量 2Cu2S+3O2 → 2Cu2O+2SO2
n(Cu)=6(![]() )=3 (mol)
)=3 (mol)
