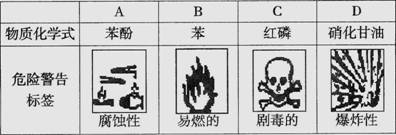
6、对于易燃、易爆有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列物质,贴错了包装标签的是
7、下列各种变化中,不属于化学变化的是
A. 向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B.加热胆矾得到白色的无水硫酸铜粉末
C. 向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
8、欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量二氧化碳 ⑥加入足量的苛性钠溶液 ⑦加入足量的三氧化铁溶液 ⑧加入乙酸与浓硫酸混合液加热。合理的操作程序是
A. ④⑤③ B. ⑥①⑤③ C. ⑧① D. ⑧②⑤③
9、下列各组溶液中,不用其它化学试剂,而用物质间两两混合的方法不可能鉴别出的是
A. NaOH、AlCl3、盐酸、Na2CO3
B. BaCl2、AgNO3、Na2CO3、CaCl2
C. 淀粉、淀粉和KI、KI、溴水
D. NaHCO3、稀硫酸、Na2SiO3、Na2SO3
10、我国首创的铝—空气—海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是
①Fe-2e-===Fe2+ ②Al-3e- ===A13+ ③O2+2H2O+4e- ===4OH-
④4Al+3O2+6H2O===4Al(OH)3 ⑤2Fe+O2+2H2O===2Fe(OH)2
A.②③④ B.①③⑤ C.①⑤ D.③④
11、有含C、H、O三种元素的有机物完全燃烧时生成的二氧化碳与消耗的氧气的物质的量之比为4∶5,并知分子中氧原子与氢原子的物质的量之比小于1∶2,则该有机物可能是
A.CH3OH B.CH3CH2OH
C.HO-CH2-CH2-OH D.HCHO
12、下列实验能取得成功的是
A.用氢氧化钠溶液和硝酸银溶液检验氯代烃中的氯元素
B.用硝酸银溶液区分二氧化氮和溴蒸气
C.用酸性高锰酸钾溶液除去一氧化碳中混有的少量乙烯
D.用氢气除去乙烷中混有的少量乙烯
13、某有机物X(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多,经测试,该化合物具有如下性质:
①l mol X与足量的金属钠反应产生1.5 mol H2
②X与醇(ROH)或羧酸(RCOOH)在浓H2SO4和加热条件下均可反应生成有香味的产物
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,下列对X的结构的判断正确的是
A.X分子中肯定有碳碳双键
B.X分子中可能有三个羟基和一个-COOR官能团
C.X分子中可能有三个羧基
D.X分子中可能有一个羟基二个羧基
26、(15分)下列图中是中学化学的常见物质,其中E、F、G、Z、W是单质,B的化学式是E2F3。它们有如下图所示的转化关系:
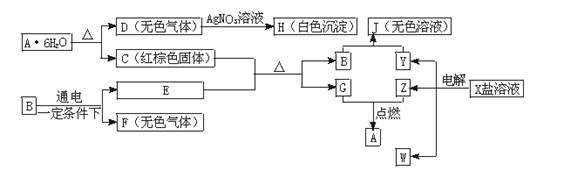
(1)F、H的化学式分别是_______________ 、 __________________。
(2)C+E反应的化学方程式是________________________ 。
(3)简要说明A·6H2O可转变为C和D的原因是____________________。
(4)写出电解X溶液的离子方程式_____________________________。
(5)写出B和Y溶液反应生成J的化学方程式____________________________。
27、(15分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
![]() 食盐+H2O NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是 。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
食盐+H2O NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是 。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
|
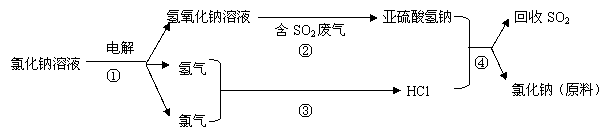 |
写出②④的化学反应方程式: 、
上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
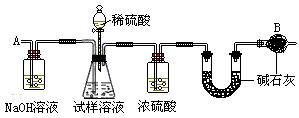 28、(15分) 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
28、(15分) 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸;直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________
(2)装置中干燥管B的作用是_________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)
(4)步骤⑤的目的是_________
(5)步骤⑦的目的是_________
(6)该试样中纯碱的质量分数的计算式为_________
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
29、(15分)三十烷醇是一种优良的植物生长调节剂,有促进种子萌芽,促进植物根系发育生长和叶绿素的合成等多种功能。工业上以十二二酸为原料合成三十烷醇的过程如下:
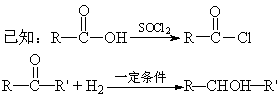
(R、![]() 均代表烃基)。
均代表烃基)。

请回答下列问题:
(1)写出物质的结构简式:A___________________、B___________________。
(2)若转化④是通过若干个反应完成的,请设计由C→D的转化途径(用化学方程式表示):
(3)转化①所属的反应类型是______________。
化学答题卡
26、(15分)(1)_______ __ _____ 、 _____ _____________。
(2)_________________ _______ 。
(3)__________________ _ _。
(4)___________________ __________。
(5)_________________ ___________。
27、(15分)
(1) 。
(2)
(3) 。 。
(4) 、
28、(15分)
(1) ___ _____
(2)____ ____
(3) ______ ___
(4) ____ ____
(5) ______ ___
(6)__ ______
(7):
29、(15分)
(1)A___________________、B___________________。
(2)
(3)