试卷类型:A
MAM高考理科综合仿真试题(五)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1至5页,第Ⅱ卷第6至12页。满分为300分,考试时间为150分钟。
第Ⅰ卷(选择题 共132分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 O:16 Cl:35.5
一、选择题(本题共22小题,每小题6分,共132分,每小题的四个选项中只有一项符合题意)
1.水资源短缺是制约我国西北地区经济发展的主要因素之一,如在开发西北的过程中,为了满足经济发展的需要,大力开采地下水,必然会对当地的生态环境产生影响。在下列的有关分析中,你认为不正确的是
A.在不影响地下水资源平衡的条件下,开采适量的地下水用于灌溉,有利于农业生产的可持续发展
B.超量开采地下水,必然会造成地下水位的下降,使得当地的具有发达根系的旱生植物因根系够不着地下水而枯死,从而加速了荒漠的过程
C.地下水抽到地表用于灌溉,地表水再下沉到地下形成地下水,由于这种循环方式的存在,大力开采地下水资源不仅有利于农业生产的发展,对生态环境的改善也是有益的
D.利用基因工程,培育一些特别耐干旱的经济作物,对促进西北地区的农业经济的可持续发展是有利的
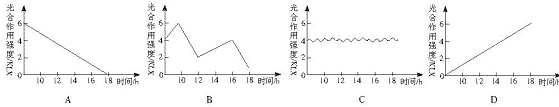
2.光照强度和CO2浓度是影响光合作用的两个主要外界因素,下图是北方夏季一天中棉花叶片光合作用强弱的变化曲线。正确的图解是
3.下列最说明酶具有高效性的实验是
A.将FeCl3溶液和过氧化氢酶分别加入盛有等量的H2O2的甲、乙两支试管中,乙试管中释放氧气的速度远远大于甲试管
B.将10%的淀粉酶和稀释10倍的淀粉酶液分别加入盛有等量的1%淀粉溶液的甲、乙两试管中,淀粉分解的速度基本相等
C.将相同数量的人的唾液淀粉酶和萌发的小麦种子的淀粉酶加入盛有等量的1%淀粉溶液的甲、乙两支试管中,发现甲试管中分解淀粉的速度比乙试管中的快
D.将淀粉酶液等量加入盛有等量1%的淀粉溶液的甲、乙两支试管中,甲、乙分别保温在10℃和30℃条件下,结果乙试管中淀粉分解的速度快于甲
4.将酵母菌磨碎,离心分离后,得到上清液(含细胞质基质)和沉淀物(含细胞器);把等量上清液沉淀物和未离心处理的匀浆分别放入甲、乙、丙3支试管中,进行四组实验。
下列对实验的有关叙述,不正确的有
A.向3支试管中分别滴加等量的葡萄糖溶液,只有乙无反应
B.向3支试管中分别滴加等量的丙酮酸溶液,只有甲没有反应
C.隔绝空气的条件下,重复“A”中所述实验,只有乙无反应
D.隔绝空气的条件下,重复“B”中所述实验,甲乙均无反应,丙有反应
5.有关“生产者是生态系统的主要成分”的理解,正确的是
①生产者能将无机物合成有机物,为消费者提供食物和栖息场所
②生产者的呼吸作用将有机物分解成无机物,实现了物质的循环
③绿色植物的蒸腾作用降低了环境温度
④流经生态系统的总能量是生产者所固定的太阳能的总量
A.①② B.②③ C.③④ D.①④
6.下列变化不属于化学变化的是
A.绿色植物的光合作用 B.工业上由石墨制取金刚石
C.豆科植物根瘤菌固氮 D.从煤焦油中提取二甲苯
7.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
8.下列反应的离子方程式书写正确的是
A.Mg(HCO3)2溶液中加入足量的NaOH溶液:
Mg2++2HCO![]() +2OH-=MgCO3↓+CO
+2OH-=MgCO3↓+CO![]() +2H2O
+2H2O
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO![]() =BaSO4↓
=BaSO4↓
D.NaOH溶液中通入过量CO2气体:CO2+OH-=HCO![]()
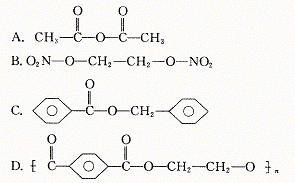
9.下列化合物不属于酯类的是
10.在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl和K2SO4,混合均匀,取溶液,用惰性电极电解,片刻后在两个电极上析出的氧化产物与还原产物物质的量之比为
A.35.5∶108 B.1∶2 C.108∶35.5 D.8∶1
11.在一密闭容器中,反应aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.化学计量数关系a>b
12.等体积,等物质的量浓度的NaCl和NaF溶液,两份溶液中离子总数相比
A.前者多 B.后者多 C.一样多 D.无法判断
13.25℃时,将某强酸和某强碱溶液按1∶10的体积比混合后溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是
A.12 B.13 C.14 D.15
14.下列说法中,不正确的是
A.离子化合物中可能含有非极性键
B.共价化合物中肯定不含有离子键
C.晶体中含有阳离子时,不一定含有阴离子
D.全部由非金属元素形成的化合物一定是共价化合物
15.光子的能量为hv动量的大小为![]() ,如果一个静止的放射性元素的原子核在发生γ衰变时只发出一个γ光子,则衰变后的原子核
,如果一个静止的放射性元素的原子核在发生γ衰变时只发出一个γ光子,则衰变后的原子核
A.仍然静止
B.沿着与光子运动方向相同的方向运动
C.沿着与光子运动方向相反的方向运动
D.可能向任何方向运动
16.我国是世界上能够发射地球同步卫星的少数国家之一,关于同步卫星正确的说法是
A.可以定点在南京上空
B.运动周期与地球自转周期相同的卫星肯定是同步卫星
C.同步卫星内的仪器处于超重状态
D.同步卫星轨道平面与赤道平面重合
17.下列说法中正确的是
①光导纤维是利用光的全反射现象
②雨后天空的彩虹是光的色散现象
③根据经典电磁理论可知,原子十分稳定,原子光谱是线状光谱
④光电效应表明光具有粒子性,从而否定了光的波动性
A.①②④ B.①② C.③④ D.②③④
18.下列是一些说法:
①一质点受两个力作用且处于平衡状态(静止或匀速),这两个力在同一段时间内的冲量一定相同
②一质点受两个力作用且处于平衡状态(静止或匀速),这两个力在同一段时间内做的功或者都为零,或者大小相等符号相反
③在同样时间内,作用力和反作用力的功大小不一定相等,但正负号一定相反
④在同样时间内,作用力和反作用力的功大小不一定相等,正负号也不一定相反
以上说法正确的是
 A.①② B.①③ C.②③ D.②④
A.①② B.①③ C.②③ D.②④
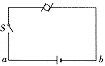
19.一只玩具电动机用一节干电池供电,闭合开关后发现电机转速较慢,经检测电动机性能完好,S闭合时用电压表测ab间电压只有0.6 V,断开开关S,测得ab间电压接近1.5 V,则电动机转速慢的原因是
A.开关S接触不良
B.电动机两端导线接触不良
C.电动机两端接线短路
D.电池过旧,内阻过大
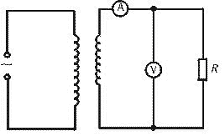
20.如图为一理想变压器,原线圈匝数为n1=1000匝,副线圈匝数n2=100匝,电阻R=10 Ω。原线圈中接有220 V的正弦式电流,电压表和电流表均为理想电表,则电压表和电流表读数分别是
A. 22![]() V,2.2
V,2.2![]() A
A
B.22 V,2.2![]() A
A
C.22 V,2.2 A
D.22![]() V,2.2 A
V,2.2 A
21.如图所示,a、b、c是一条电场线的三点,电场线方向由a到c,ab间距离等于bc间距离,用Φa、Φb、Φc和Ea、Eb、Ec分别表示a、b、c三点的电势和场强可以判定
![]()
A.Φa>Φb>Φc
B.Ea>Eb>Ec
C.Φa-Φb=Φc-Φd
D.Ea=Eb=Ec
22.电磁流量计广泛应用于测量可导电流体(如污水)在管中的流量(在单位时间内通过管内横截面的流体的体积)。为了简化,假设流量计是如图所示的横截面为长方形的一段管道,其中空部分的长、宽、高分别为图中的a、b、c。流量计的两端与输送流体的管道相连接(图中虚线),图中流量计的上下两面是金属材料,前后两面是绝缘材料,现于流量计所在处加磁感应强度为B的匀强磁场,磁场方向垂直于前后两面,当导电流体稳定地流经流量计时,在管外将流量计上、下两表面分别与一串接了电阻R的电流表的两端连接,I表示测得的电流值,已知流体的电阻率为ρ,不计电流表的内阻,则可求得流量为
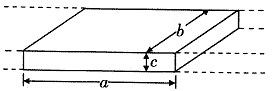
A.![]()
B.![]()
C.![]()
D.![]()
第Ⅱ卷(非选择题 共168分)
注意事项:
1.第Ⅱ卷共7页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 题号 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | Ⅱ卷总分 |
| 得分 |
23.(17分)下面示光合作用的实验过程:
![]() ①选一株银边天竺葵,预先放在阴暗处两昼夜,再用2 cm×2 cm不透光的黑纸用大头针别在这株天竺葵叶片的绿色部位(如右图),然后将其放在阳光下照射6~8小时,剪下该叶片,并用瓶塞穿孔器分别在叶片的不同部位取A、B、C三个圆叶片(B为遮光处取下的圆片,C为银边处取下的圆片)
①选一株银边天竺葵,预先放在阴暗处两昼夜,再用2 cm×2 cm不透光的黑纸用大头针别在这株天竺葵叶片的绿色部位(如右图),然后将其放在阳光下照射6~8小时,剪下该叶片,并用瓶塞穿孔器分别在叶片的不同部位取A、B、C三个圆叶片(B为遮光处取下的圆片,C为银边处取下的圆片)
②将3个叶圆片放在装有酒精的试管里经热水浴脱色,并将它们放在清水中漂洗。
③再将经过漂洗的叶圆片放在白纸上,然后用吸管吸取碘液,分别滴在三个叶圆片上
请分析回答:
(1)将天竺葵预先放在阴暗处两昼夜的目的是_____________________________。
(2)将叶片放在装有酒精的试管里经热水浴脱色是为了____________________________。
(3)分析A、B、C三个叶圆片的颜色反应的情况:
A:__________________________________________________________________;
B:__________________________________________________________________;
C:__________________________________________________________________。
(4)把叶圆片A切成薄片制成装片放在显微镜下观察,发现细胞中分散着被染成蓝色结构的是_____________,光合作用的产物淀粉是在_____________________________阶段形成的。
(5)该实验证明光合作用的必需条件是__________________________________,场所是_____________________________________。
24.(12分)阅读下列资料,回答有关问题:
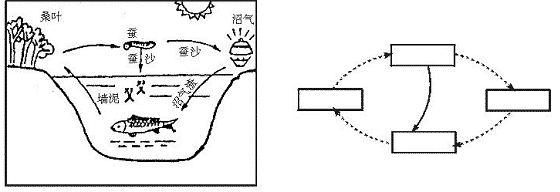
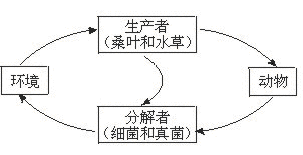
(1)依据下面“桑基鱼塘”生态农业系统图,在右侧方框内填出恰当文字,揭示其物质循环过程。
 (2)HGPRT缺陷症的致病基因在X染色体上,患者发病时有自残行为。下图是一个该缺陷症的家族系谱图。请分析回答:
(2)HGPRT缺陷症的致病基因在X染色体上,患者发病时有自残行为。下图是一个该缺陷症的家族系谱图。请分析回答:
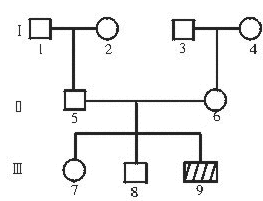
①此病的致病基因为隐性基因,理由是_____________________________________。
②9号同时患有红绿色盲,在9号形成配子时,色盲基因与该缺陷症基因之间是否遵循基因的独立分配遗传规律?____________________________。
③如果7号与一正常男子婚配,所生子女中患该缺陷症的概率为______________。
④如果9号与一正常女子(来自世代无此病的家族)婚配,从优生的角度考虑,应考虑生育何种性别的后代?简要说明理由。______________________________________。
25.(20分)已知X、Y均为短周期元素,X在空气中燃烧发出耀眼白光。气体G与氢气密度之比为8.5,B是一种化肥的重要组成部分,可由人体 肝脏产生,也可由C分解而成。D是一种高分子化合物,能作为重金属盐中毒后的解毒剂。
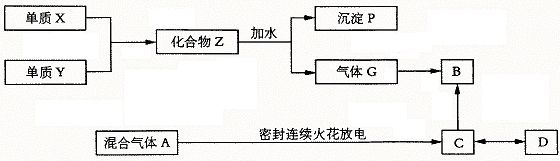 (1)写出X、Y、Z、P、G的化学式。
(1)写出X、Y、Z、P、G的化学式。
(2)写出B、C、D的名称。
(3)A中所含的主要气体成分是______________,这一实验最先由___________________设计完成。
(4)C分解成B是通过____________________作用。D是生物体内的_________________细胞器合成。
(5)Z与水的反应方程式是_____________________,并计算生成1 mol气体G时应同时得到_____________mol沉淀P。
26.(12分)双氧水(H2O2)属于“绿色化学”试剂,它具有强氧化性、漂白性和弱酸性。极纯的双氧水很稳定。
(1)某研究性学习小组研究过氧化钠跟水等物质的反应,进行如下实验:向盛有少量过氧化钠固体的试管中滴加水,直至气体不再放出,加入稀释,将所得溶液平均盛放在七支试管中,一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去;另六支试管中分别加入少量二氧化锰、氧化铜、土豆泥、生锈的铁钉、新鲜动物肝脏或用波长为320~380 nm的光照射后,又有气体放出,待气体放出后,再滴加酚酞,溶液变红,持久不褪色。请写出:
①过氧化钠跟水反应的化学方程式:a._____________;b.____________。
②加入二氧化锰等后溶液中发生反应的化学方程式是________________________,反应中二氧化锰、氧化铜、土豆泥、生锈的铁钉、新鲜动物肝脏的作用是___________________。
③新鲜动物肝脏的提取液稀释10倍与原溶液实验效果基本相同,这表明新鲜肝脏对该反应具有_______________________。
A.专一性 B.多样性 C.高效性 D.稳定性
④研究性学习的结论之一为:“过氧化钠与水反应的还原产物为水,而不是氢氧化钠。”这个结论是否正确?为什么?_________________________________________。
(2)将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲学生认为这是由于H2O2是二元弱酸,消耗了OH-,而使红色褪去;乙学生认为,H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位学生的解释中哪种正确?
________________________________________________________________________________________________________________________________________________________________________________________________________________。
27.(18分)由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2中,所有原子是否都满足8电子结构?______________(填“是”或“否”)。
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2的一半。这一反应的化学方程式是___________________________________。
(3)浓盐酸在上述反应中显示出来的性质是_______________(填写编号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(4)若上述反应产生0.1 mol Cl2,转移电子的物质的量为_______________mol。
(5)ClO2为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是Cl2的_____________倍。
(6)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是_______________________________。和欧洲的方法相比,我国这一方法的主要优点是_______________________________。
28.(16分)下图中A是H2发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,D是装有还原铁粉的反应管。实验前先检查实验装置 的气密性。实验开始时,先关闭活塞W,并取下烧瓶B;向A中加入一定量浓度的盐酸适量,产生H2。经必要的操作后,在导管的出口处点燃氢气,然后如图所示套上烧瓶,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞W,B瓶中的气体通过U形管后在D中
反应,进入E,最后进入F中(F中装有某种物质的溶液,作检验之用)。
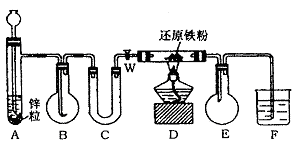
请回答下列问题:
(1)实验前如何检查装置气密性?
__________________________________________________________________________________________________________________________________________________________________________________________________________。
(2)点燃H2前必须进行什么操作?为什么?
__________________________________________________________________________________________________________________________________________________________。
(3)写出B、D中分别发生反应的化学方程式。
B中______________________________________________________。
D中______________________________________________________。
(4)U形管中,应盛试剂是_______________,其作用是____________________。
(5)E装置作用是______________________________。
(6)F中可装_____________的溶液,发生的现象为______________________________。
29.(12分)据统计,40%的飞机失事时,机舱内壁和座椅的塑料会着火冒烟,导致舱内人员窒息而死。为此,寻找装修机舱的阻燃聚合物是化学研究的 热点之一。最近,有人合成了一种叫PHA的聚酰胺类高分子。温度达180℃~200℃时,PHA就会脱去水分子变成PBO,后者着火点高达600℃,使舱内人员逃离机舱的时间比通常增大10倍。该发明创造的巧妙之处还在于,PHA是热塑性的塑料,而PBO却十分坚硬,是热固性的塑料。
(1)若某机舱内壁、座椅均为聚丙烯塑料,在飞机失事后,试推测聚丙烯燃烧过程中,产生的气体可能是:____________。产生的固体物质可能是:____________________。
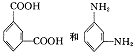
(2)Nomex纤维是一种新型阻燃性纤维它可用 在一定条
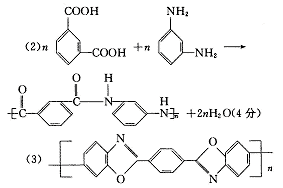
件下按等物质的量缩聚而成,用化学方程式表示这一过程:
________________________________________________________________
(3)已知PHA的结构式为:
![]()
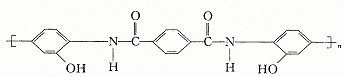
试写出当温度达到180℃~200℃时,由于链节中羰基 上的氧原子活化,故PHA结构式每一个链节中以羰基上的氧原子为中心,而脱去2个水分子形成PBO的结构简式。
30.(15分)电阻R1、R2、R3连结成图示的电路,放在一个箱中(虚线框所示),箱面上有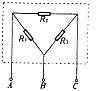 三个接线柱A、B、C.请用多用表和导线设计一个实验,通过在A、B、C的测量,确定各个电阻的阻值.要求写出实验步骤并用所测值表示电阻R1、R2、R3.
三个接线柱A、B、C.请用多用表和导线设计一个实验,通过在A、B、C的测量,确定各个电阻的阻值.要求写出实验步骤并用所测值表示电阻R1、R2、R3.
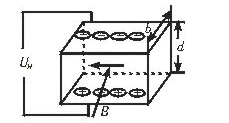
31.(13分)1879年美国物理学家霍尔在研究载流导体在磁场中受力性质时,发现了一种前所未知的电磁效应:若将通电导体置于磁场中,磁感应强度B垂直于电流I方向,如图所示,则在导体中垂直于电流和磁场的方向会产生一个横向电势差UH,称其为霍尔电势差,根据这一效应,在测出霍尔电势差UH、导体宽度d、厚度b、电流I及该导体的霍尔系数H(H=1/nq,其中n为单位体积内载流子即定向移动的电荷的数目,q为载流子的电量),可精确地计算出所加磁场的磁感应强度表达式是什么?
32.(15分)雷鸣电闪是日常生活中司空见惯的自然现象,地球上每年平均发生31万余次闪电。
(1)写出每当雷鸣闪电之时,空气中可能会发生的四种反应的方程式;并由此说明闪电对人类生活有何益处?
(2)设某次雷电中,两块云团间的电势差约为10 V,放电电量约为15 C,在闪电过程中,空气中的氮气和氧气直接化合,已知每摩氧气和氮气化合时要吸收180.74 kJ的能量,闪电时有1/1000的能量用于这一反应,那么:此次闪电所产生的NO的物质的量有多大?此一次雷电的生成物相当于给土地施了多少尿素化肥?
(3)火花放电可以为无机小分子生成有机小分子创造条件,其机制是
A.通过电场将气体电离或断开化学键
B.通过电场使气体分子加速碰撞
C.提供能量使气体分子能级增大
D.火花放电发出的光,加速化学反应
 33.(18分)如图所示,M为悬挂在竖直平面内某一点的木质小球(可以看作质点),悬线长为L,质量为m的子弹以水平初速v0射入球中而未射出,要使子弹射入小球后,小球能在竖直平面内运动,悬线始终不发生松弛,求子弹的初速度v0的大小应满足的条件。(空气阻力不计)
33.(18分)如图所示,M为悬挂在竖直平面内某一点的木质小球(可以看作质点),悬线长为L,质量为m的子弹以水平初速v0射入球中而未射出,要使子弹射入小球后,小球能在竖直平面内运动,悬线始终不发生松弛,求子弹的初速度v0的大小应满足的条件。(空气阻力不计)
MAM高考理科综合仿真试题(五)答案
一、1.C 2.B 3.A 4.D 5.D 6.D 7.A 8.D 9.A 10.B 11.C 12.A 13.B 14.D 15.C 16.D 17.B 18.D 19.D 20.C 21.A 22.A
二、23.(1)耗尽叶肉细胞中的淀粉(2分)
(2)避免叶绿素对淀粉遇碘变蓝这一实验结果的干扰(2分)
(3) A.含叶绿体,在光照下进行光合作用制造淀粉,遇碘变蓝(3分)
B.含叶绿体,但无光不能进行光合作用,不含淀粉,遇碘不变蓝(3分)
C.不含叶绿体,虽经光照,但不能进行光合作用,不含淀粉,遇碘不变蓝(3分)
(4)叶绿体(1分) 暗反应(1分)
(5)光能(1分) 叶绿体(1分)
24.(12分)(1)(每空1分,共4分)
(2)(共8分)
①9是男患者,但其母表现型正常(2分) ②不符合(2分) ③1/8(2分) ④应考虑生男孩,因为所生男孩都不带致病基因,而女孩都是携带者(2分)
25.(1)X.Mg Y.N2 Z.MgN2 P.Mg(OH)2 G.NH3(5分)
(2)B.尿素(1分) C.氨基酸(1分) D.蛋白质(1分)
(3)甲烷、氢气、氨气、水蒸气(2分) 米勒(2分)
(4)脱氨基(2分) 核糖体(2分)
(5)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
1.5 mol(4分)
26.(12分)(1)①a.2Na2O2+2H2O=4NaOH+O2↑
|
②2H2O2 2H2O+O2↑ 催化剂(2分)
③C(2分)
④正确,因为Na2O2与 H2O反应时先发生复分解反应,生成物为NaOH和H2O2,无化合价升降,然后H2O2分解为O2和H2O的反应才是氧化还原反应,且H2O是还原产物。(3分)
(2)向褪色后的溶液中加入少量氢氧化钠溶液使溶液显碱性,如果溶液变红,说明甲学生的解释正确;反之,说明乙学生的解释正确。(3分)
27.(1)否(3分)
(2)2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O(3分)
(3)B(3分) (4)0.2(3分) (5)2.63(3分)
(6) 2NaClO2+Cl2=2NaCl+2ClO2;
对环境的污染较小(生成的ClO2中不含Cl2杂质)(3分)
28.(1)关闭W,用手握住E瓶,或微热D管,若F中导气管处有气泡排出,松开手或停止加热,导气管中有一段水柱上升,证明W→F气密性好。(2分)
在A中,从长颈漏斗处加水至浸没长颈漏斗下口端(液封),再关闭W,用手握住烧瓶B(或微热B),若A中水沿长颈部分上升一段水柱,松手或停止加热后,水柱回落,证明A→W部分气密性好。(2分)
|
(3)B中:2H2+O2 2H2O
|
|
(4)碱石灰;除去HCl和水蒸气(2分)
(5)防止水倒吸进入D中加热的试管中,兼收集NH3的作用(2分)
(6)酚酞溶液;溶液由无色变成红色(2分)
29.(12分)CO2、CO;烟尘(游离态碳)(4分)
(4分)
30.R1=![]() ,R2=
,R2=![]() ,R3=
,R3=![]()
【解析】 利用导线短接电路进行测量:
①用导线连结BC,测得A、B间电阻为x。(3分)
②用导线连结AB,测得B、C间电阻为y。(3分)
③用导线连结AC,测得B、C间电阻为z。(3分)
则有:![]()
联立得:R1=![]() ,R2=
,R2=![]() ,R3=
,R3=![]() (6分)
(6分)
若不用导线短接,直接测量,但列式较复杂:
①测出A、B间电阻值x。
②测出B、C间电阻值y。
③测出A、C间电阻z。
则由![]() ,解得
,解得
R1=![]() [2(xy+yz+xz)-x2-y2-z2]
[2(xy+yz+xz)-x2-y2-z2]
R2=![]() [2(xy+yz+xz)-x2-y2-z2]
[2(xy+yz+xz)-x2-y2-z2]
R3=![]() [2(xy+yz+xz)-x2-y2-z2]
[2(xy+yz+xz)-x2-y2-z2]
31.本题根据霍尔效应立意命题,考查带电粒子在复合场中的平衡问题,解题的关键在于弄清霍尔电势差产生的原因,以及稳定时载流子的受力特征。(4分)
当导体中的载流子达到稳定时有Eq=qvB
又对匀强电场有E=![]() (4分)
(4分)
电流强度的微观表达式为I=nqvs=nqvdb
|
|
3NO2+H2O=2HNO3+NO,3O2 2O3
闪电时可把空气中的氮(N2)转化为氮肥(“固氮”反应,每年约有48300万吨),落到地面上后可发生2HNO3+Ca(HCO3)2=Ca(NO3)2+2H2O+2CO2↑或2HNO3+(土壤胶体)Ca2+→Ca(NO3)2+(土壤胶体)2H+,形成硝酸盐以利作物生长。(5分)
说明:氮是农作物体内蛋白质,核酸和叶绿素的重要成分,氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。豆类等植物的根部有根瘤菌,能把空气中的氮气转变为氨作为养料吸收,是植物生长发育的基本条件之一,推动着自然界周而复始的氮循环,保持着生态平衡。当然,现代农业并不单纯仅仅依靠等待大自然的恩赐。
(2)闪电放出的能量W=qU=1.5×1010 J,由反应式O2+N2=2NO知,每摩尔O2与N2化合生成2 mol NO时吸收180.74 kJ能量,由此可求得此次闪电生成的NO物质的量n=1.66×102 mol(4分)
由于2 mol NO 能生成1 mol (NH2)2CO,则尿素的总质量M=(n/2)×60 (g/mol)×10-3= 4.98 kg.(2分)
(3)米勒实验证实,火花放电为无机小分子生成有机小分子创造了条件,火花放电为这种转化提供了能量,其机制是火花放电通过电场将气体电离或断开化学键。(2分)
【答案】见解析
33.解:由于子弹初速度大小的具体数值未定,因此子弹和木球作用后的共同速度可大可小,速度较大时,可能在竖直平面内做圆周运动;速度较小时,可能在竖直平面内来回运动,我们可作如下讨论:
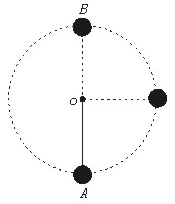
(1)子弹初速度较大时,小球在竖直平面内做圆周运动,子弹和木球在水平方向上动量守恒mv0=(M+m)vA (3分)
子弹和木球一起做圆周运动,由A运动到B有
![]() (M+m)vB2+(M+m)g2L=
(M+m)vB2+(M+m)g2L=![]() (M+m)vA2 (3分)
(M+m)vA2 (3分)
在B点有(M+m)vB2/L≥(M+m)g 故而,v0≥![]() (4分)
(4分)
(2)子弹初速度较小时,木球在竖直平面内来回运动,子弹和木球在水平方向上动量守恒,mv0=(M+m)v A′(3分)
设小球到达与悬点O相平的C点时速度刚好为零,这时子弹和木球一起由A运动到C有:
![]() (M+m)vA2=(M+m)gL 由此得到,v0=
(M+m)vA2=(M+m)gL 由此得到,v0=![]() (3分) 所以,子弹的初速大小范围为v0≥
(3分) 所以,子弹的初速大小范围为v0≥![]() 或v0≤
或v0≤![]() (2分)
(2分)
注:计算题解答中只要方法、原理、步骤合理、结果正确,用其他方法解,照样给分。